
科目: 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的部分工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1) 吸收塔内的反应的化学方程式为
2NaOH+2ClO2+ H2O2=== 2NaClO2+ 2 + ,
若1 mol ClO2参加反应,则转移电子的物质的量是 mol;
(2)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号),
a.蒸馏 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称);
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 ;
(4)160 g/L NaOH溶液的物质的量浓度为 ,若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
查看答案和解析>>
科目: 来源: 题型:
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;⑦……
请根据上面叙述,回答:
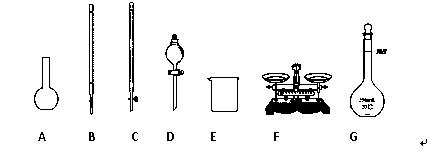
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g;再次加热并冷却室温称量其质量为m2g,且m1-m2=0.3,接下来的操作应当是 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的。你认为甲学生的观点是否正确? (填“正确”或“错误”),请说明理由:
。
查看答案和解析>>
科目: 来源: 题型:
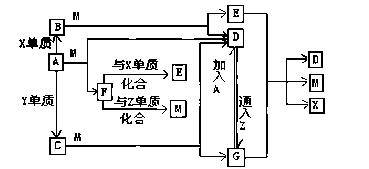
已知A是应用最为广泛的金属, X,Y为同一主族的元素的单质, B和C是两种黑色化合物。A.B.C与有关物质之间的相互转化关系如下图所示,其中每一方格内的字母表示一种反应物或生成物,反应加入或生成的水已略去。
填写下列空白:
(1)物质的化学式:A_________________,B______________,C_________________。
(2) 写出反应的化学方程式:
B+M:_____________________________________________________
C+M:_____________________________________________________
(3)写出E与G反应的离子方程式:___________________________________________
查看答案和解析>>
科目: 来源: 题型:
在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol / L的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是( )
A.混合物里3种物质反应时消耗盐酸的物质的量之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:3(不考虑Fe2+水解)
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
查看答案和解析>>
科目: 来源: 题型:
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入2.5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A 60mL B.240mL C.30mL D.120mL
查看答案和解析>>
科目: 来源: 题型:
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(还原性I->Fe2+>Br->Cl-)( )
A.7∶1 B.7∶2 C.7∶3 D.7∶4
查看答案和解析>>
科目: 来源: 题型:
标准状况下a L H2和Cl2的混合气体,经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转变成盐,则a、b的关系不可能是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() ≥
≥![]()
查看答案和解析>>
科目: 来源: 题型:
铜既不溶于稀硫酸,也不溶于KNO3 溶液,现有2mol/L稀硫酸300mL,往其中加入40.4g KNO3 晶体,晶体全部溶解,该混和液最多可溶解铜的物质的量为 ( )
A. 0mol B. 0.15mol C. 0.45mol D.0.6mol
查看答案和解析>>
科目: 来源: 题型:
某澄清透明溶液中只可能含有:![]() ;
;![]() 中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是( )
中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是( )
A.②⑤⑦ B.②③⑤⑦
C.③⑤⑦ D.①②③④⑤⑦

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com