
科目: 来源: 题型:
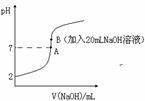
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF![]() H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
 已知:电离度(
已知:电离度(![]() )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__ ,
电离度![]() 为_ _%。
为_ _%。
(3)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)已知该温度下Ksp(CaF2)=1.5×10-10。取B点时的溶液10mL与90mL1×10-4 mol·L-1 CaCl2溶液混合,通过列式计算说明是否有沉淀产生。
查看答案和解析>>
科目: 来源: 题型:阅读理解
I 某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)

(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯,(填“A”或“B”),
(2)锌电极为电池的_________极,发生的电极反应式为________________________;铜电极上发生的电极反应式为___________________________;
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(3)对于实验中产生电流的原因,该小组进了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池,B成了用电器。对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的电极反应式为:正极:_________________________________
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的电极反应式为:正极:____________________________
(4)若第(3)问中②观点正确,则可以利用此原理设计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,最终铝变成氢氧化铝。请写出该电池工作时总反应的化学方程式_____________________________________
查看答案和解析>>
科目: 来源: 题型:
草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol?L―1的H2C2O4溶液滴加0.01mol?L―1KOH溶液V(mL),回答下列问题。
(1)当V<10mL时,反应的离子方程式为 。
(2)当V=10mL时,溶液中HC2O4―、C2O42―、H2C2O4、H+的浓度从大到小的顺序为 。
(3)当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42―)+c(HC2O4―);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42―)+c(HC2O4―)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
(4)当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”)
查看答案和解析>>
科目: 来源: 题型:
常温度下,将Cl2缓慢通人水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中 溶液的pH变化曲线如右图所示。下列选项正确的是( )
A. a点所示的溶液中![]()
B. b点所示的溶液中![]()
C. c点所示的溶液中![]()
D. d点所示的溶液中![]()

查看答案和解析>>
科目: 来源: 题型:
25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关叙述不正确的是
A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-) >c(H+)>c(OH-)
B.由图可知该温度下醋酸的电离常数为1×10-4.75
C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向1L W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):
2c(H+)+ c(CH3COOH)= c(CH3COO-)+2c(OH-)+2 c(Cl-)

查看答案和解析>>
科目: 来源: 题型:
锂离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6,充放电过程中,正极发生LiCoO2与Li1-xCoO2之间的转化。下列有关说法不正确的是:( )
A.放电时的负极反应式为: LixC6-xe-=6C+xLi+
B.钴酸锂(LiCoO2)中钴元素的化合价为+3
C.放电时正极发生LiCoO2转化为Li1-xCoO2的反应
D.放电时锂离子向正极移动
查看答案和解析>>
科目: 来源: 题型:
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al + 3Ag2S = 6Ag + A12S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目: 来源: 题型:
均为0.1mol/L的醋酸溶液和盐酸,分别用蒸馏水稀释到原溶液的m倍和n倍,稀释后两溶液的pH相同,则m和n的关系是( )
A.m=n B.m>n C.m<n D.无法判断
查看答案和解析>>
科目: 来源: 题型:
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= 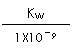 mol·L—1
mol·L—1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目: 来源: 题型:
下列各组离子在指定溶液中,能大量共存的是( )
①无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
②pH=13的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
③由水电离出的![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
④强酸性溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
⑤强酸性溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
A.②③④ B.②④⑤ C.①②⑤ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com