
科目: 来源: 题型:
关于Na2CO3和NaHCO3性质的有关叙述正确的是( )
A、在水中溶解性:Na2CO3<NaHCO3
B、热稳定性:Na2CO3>NaHCO3
C、与酸反应的速度:Na2CO3>NaHCO3
D、Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3
查看答案和解析>>
科目: 来源: 题型:
下列溶液中能大量共存的离子组是( )
A、加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br-
B、某无色透明溶液中 Cu2+、Na+、Cl-、HCO![]()
C、含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D、在pH=1的溶液中:ClO-、NH4+、K+、Cl-
查看答案和解析>>
科目: 来源: 题型:
人体的血糖浓度(血液中葡萄糖C6H12O6的含量)是人体的重要生理指标,其值常以两种计量单位表示,即“m mol/L”和“mg/d L”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11m mol/L之间,下列血糖浓度属于正常值的是( )
A、2.88m mol/L B、0.008 mol C、95mg/dL D、52mg/dL
查看答案和解析>>
科目: 来源: 题型:
下列关于硅单质及其化合物的说法正确的是( )
① 硅是构成一些岩石和矿物的基本元素 ② 水泥、玻璃、水晶饰物都是硅酸盐制品
③ 高纯度的硅单质广泛用于制作光导纤维 ④ 陶瓷是人类应用很早的硅酸盐材料
⑤ 硅胶是硅酸凝胶经干燥脱水后得到的多孔固体
⑥ 氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
⑦ 光导纤维是一种新型的无机非金属材料,主要成份为SiO2
A、①④⑤⑥⑦ B、①②④⑤⑥⑦ C、①②④⑤⑦ D、全部
查看答案和解析>>
科目: 来源: 题型:
氰化钠(![]() )是工业上冶炼黄金的重要原料,工业上生产氰化钠的化学方程式为
)是工业上冶炼黄金的重要原料,工业上生产氰化钠的化学方程式为
2Na+2C+2NH3 =2NaCN+3H2↑该反应中的还原剂为( )
A、NH3 B、C和Na C、Na和NH3 D、C和NH3
查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是( )
A、利用丁达尔现象可以鉴别胶体和溶液
B、在豆浆里加入盐卤做豆腐与胶体的聚沉有关
C、胶体与溶液的分离可用渗析的方法
D、KCl溶液、淀粉溶液和纯水都属于分散系
查看答案和解析>>
科目: 来源: 题型:
硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应
2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
① 从平衡角度分析采用过量O2的目的是 ;
② 计算该条件下反应的平衡常数K=___________。ks5u
③ 已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,SO2的转化率 (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲 乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲 乙。(在①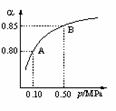 、②填入:大于、等于、小于)
、②填入:大于、等于、小于)

查看答案和解析>>
科目: 来源: 题型:
下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α________(填“<”“>”或“=”)1×10-14,作出此判断的理由是___________。
(2)25 ℃下,某Na2SO4溶液中c(SO![]() )=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(3)t2 ℃下,pH=7的溶液显________性(填“酸”、“碱”或“中”),将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________,此溶液中各种离子的浓度由大到小的排列顺序是__________________。
查看答案和解析>>
科目: 来源: 题型:
工业上用CO来生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应过程中能量的变化情况;图2表示一定温度下,向固定体积为2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物质的量
CH3OH(g)。图1表示反应过程中能量的变化情况;图2表示一定温度下,向固定体积为2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物质的量


请回答下列问题:
(1)在图1中,曲线________(填“a”或“b”)表示反应使用了催化剂;该反应属于________(填“吸热”或“放热”)反应。
(2)根据图2判断下列说法中正确的是________(填序号)。ks5u
a.起始充入的CO的物质的量为2 mol b.增大CO的浓度,CO的转化率增大
c.容器中压强恒定时,说明反应已达平衡状态
d.保持温度和密闭容器的容积不变,再充入1 mol CO和2 mol H2,再次达到平衡时,n(CH3OH)/n(CO)的值会变小。
(3)从反应开始至达到平衡,v(H2)=________。该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为________;若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数将________(填“增大”“减小”或“不变”)。
CH3OH(g)的化学平衡常数为________;若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数将________(填“增大”“减小”或“不变”)。
(4)已知CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,请写出32 g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式:___________________。
O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,请写出32 g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com