
科目: 来源: 题型:
下列说法错误的是( )
A.ns电子的能量不一定高于(n-1)p电子的能量
B.6C的电子排布式1s22s22p![]() 违反了洪特规则
违反了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
查看答案和解析>>
科目: 来源: 题型:
(1)在NaOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(Na+)=c(A-),而乙同学认为c(Na+)与c(A-) 是否相等,要看一元酸HA是强酸还是弱酸。你认为 同学的说法正确,理由是 。
(2).已知298K时, MgCO3的Ksp = 6.82×10-6,向1L c(Mg2+ ) = 0.0001 mol·L-1的MgCl2溶液中,滴加Na2CO3浓溶液,假设溶液的体积保持1L不变,当c(CO32-)= 时开始产生沉淀。
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
在427℃时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.001mol/L,则在此反应条件下氧化碳转化率为 。
查看答案和解析>>
科目: 来源: 题型:
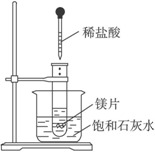
如图2-25所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。
试完成下列问题:
(提示:氢氧化钙的溶解度随温度升高而降低)
(1)实验中观察到的现象是_____________________________
___________________。
(2)产生上述现象的原因是______________________________
___________________。
(3)写出有关反应的离子方程式:________________________
________________。
(4)由实验推知,MgCl2溶液和H2的总能量______________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:
2KMnO4+10FeSO4+8H2SO4 ═ 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
步骤如下:
①称量样品3.0 g配成100 mL溶液;
②取20.00 mL待测液,置于锥形瓶中,再加入适量硫酸;
③将0.1 mol/L的标准KMnO4溶液装入滴定管,调节液面至a mL处(见下图);
④滴定待测液至滴定终点时,滴定管液面读数为6;
⑤重复滴定2~3次;
⑥计算。
(1)实验步骤③中的溶液体积读数为 。
(2)实验步骤①、③中还需要使用的最主要的仪器分别为:① 、③ 。
(3)在步骤④的滴定操作中是否需要在待测液中加入指示剂 。(填“是”或“否”)
(4)若滴定时每次消耗KMnO4溶液体积的平均值为V mL,则绿矾样品的纯度为 。(列出算式即可)如果步骤③中读数时俯视,则最终结果 。(填“偏大”、“不变”或“偏小”)
查看答案和解析>>
科目: 来源: 题型:
在一个2L的密闭容器中,发生反应:
2SO3 (g)![]() 2SO2+ O2 △H>0,其中SO3的变化如下图示:
2SO2+ O2 △H>0,其中SO3的变化如下图示:
(1)写出该反应的平衡常数表达式:
____________________________,
(2)用SO2表示从0~8min内该反应的平均速率
v= 。
(3)降低温度,该反应的反应速率将 ;
K值将__________ ;容器中气体的平均相对分子质量将________。(填:“增大”,“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是 。
a.2v正 (SO3)=v逆(O2) b.容器内压强保持不变
c.容器内密度保持不变 d.v逆(SO2)=2v正(O2)
(5)从8min起,压缩容器为1L,则SO3的变化曲线为
A. d B. c C. b D. a

查看答案和解析>>
科目: 来源: 题型:
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①③相连时,③有气泡逸出;①②相连时,外电路电子从②流向①;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
A.①③②④ B.①③④②
C.②①③④ D.③①②④
查看答案和解析>>
科目: 来源: 题型:
下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
查看答案和解析>>
科目: 来源: 题型:
在一固定体积的密闭容器中,加入2 mol A和1 mol B发生反应2A(g)+B(g)![]() 3C(g)+D(s),达到平衡,c的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是
3C(g)+D(s),达到平衡,c的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是
A.4 mol A +2 mol B
B.2 mol A+1 mol B+1.5 mol C+0.5 mol
C.3 mol C+1 mol D +1 mol B
D.3 mol C+2 mol D
查看答案和解析>>
科目: 来源: 题型:
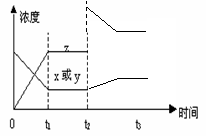
反应x(g) + y(g) ![]() 2z(g) △H<0,若反应开始经t1秒后达到平衡,t2秒后由于反应条件的改变使平衡破坏,t3时又达平衡(如图所示),试分析,从t2到t3曲线变化的原因是,t2时刻
2z(g) △H<0,若反应开始经t1秒后达到平衡,t2秒后由于反应条件的改变使平衡破坏,t3时又达平衡(如图所示),试分析,从t2到t3曲线变化的原因是,t2时刻
A.减小了x或y的浓度
B.增大了Z的浓度
C.增加了反应体系的压强
D.升高了反应的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com