
科目: 来源: 题型:
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A.Ca2+、Na+、NO3-、SO42- B.Mg2+、Cl-、Al3+、SO42-
C.K+、Cl-、HCO3-、NO3- D.Cu2+、Na+、Fe3+、NO3-
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.铁片放入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
B.大理石放入稀硝酸中:CO32-+2H+=CO2↑+H2O
C.硝酸银溶液中加入铜粉:Cu +Ag+=Cu2++Ag
D.硫酸铜与氢氧化钡溶液反应:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
分类法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据水溶液是否能够导电将化合物分为电解质和非电解质
②根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
③根据反应中是否有氧元素参与将化学反应分为氧化还原反应和非氧化还原反应
④根据分散质粒子直径的大小将分散系分为溶液、胶体、浊液
A.③④ B.①②③ C.④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液 B.75 mL 1 mol·L-1 CaCl2溶液
C.150 mL 0.2 mol·L-1 KCl溶液 D.75 mL 1 mol ·L-1 AlCl3溶液
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.标准状况下,1 mol任何物质体积均为22.4L
D.3.01×1023个SO2分子的质量为32g
查看答案和解析>>
科目: 来源: 题型:
铜单质及其化合物在很多领域有重要的用途。
(一)如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
(1)超细铜粉的某制备方法如下:
![]()
![]()
[Cu(NH3)4]SO4中所含的化学键有 。
(2)氯化亚铜(CuCl)的制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀。反应的离子方程式为 。
(二)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料。已知CuSO4·5H2O的部分结构可表示如下:
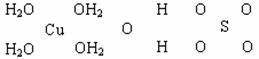
(1)写出铜原子价电子层的电子排布式____________,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有__________(填元素符号)。
(2)请在上图中把CuSO4·5H2O结构中的化学键用短线“——”表示出来。
(3)往浓CuSO4溶液中加入过量较浓的NH3·H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层,静置。经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是______________________________________________。
(4)Cu(NH3)4SO4·H2O晶体中呈正四面体的原子团是______________,杂化轨道类型是sp3杂化的原子是____________________________。
查看答案和解析>>
科目: 来源: 题型:
已知A、B、C、D、E、F六种元素的原子序数依次递增, A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满。
请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)C的基态原子的外围电子排布式为 ,周期表中F
属于 区。
(2)C、D、E三元素的电负性由大到小的顺序为: ,简单离子半径由大到小的顺序为: 。
(3)BD分子中,B原子与D原子都达到8电子稳定结构,则BD的电子式是 ;
(4)BD2与EDA反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是: 。
 (5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(6)右图分别是E和F的晶胞。晶体中E和F的配位数之比为 。
(7)相同条件下,V1mLBD2与V2mLCD的混合气体通过足量E2D2固体后,气体体积变为(V1+V2)/2mL(不考虑CD与E2D2的反应),则V1与V2的关系满足: 。
查看答案和解析>>
科目: 来源: 题型:
下表是元素周期表的前三周期主族和0族元素区,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:

(1)写由仅由e形成的两种带有相同电荷数的阴离子的符号__________、_________。
(2)d元素名称为__________,其双原子分子的电子式为____________。

(3)图Ⅰ是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是(填化学式)________晶体,1 mol该晶体中含有________mol化学键。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图Ⅱ)中序列“5”的氢化物的名称是__________,空间构型为____________;序列“2”的氢化物的结构式是________________,属于________(填“极性”或“非极性”)分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com