
科目: 来源: 题型:
将4.48g Fe溶于1L 0.1mol·L-1的稀硫酸,再加入50mL 0.4mo1·L-1KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO3-无剩余,生成一种氮氧化物NYOX。则该氮氧化物的化学式是
A.N2O B.NO C.N2O3 D.NO2
查看答案和解析>>
科目: 来源: 题型:
硫酸亚铁铵是一种重要的化工原料,以下各组溶液中加入该盐后,选项中各离子数目均没有明显减少的是
A.Na+ H+ Cl- NO3- B.Na+ Mg2+ Cl- SO42-
C.K+ Ba2+ OH- I- D. K+ S2- Br- Cl-
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式或化学反应方程式与所述事实相符且正确的是
A.将2molSO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:
2SO3(g) ![]() 2SO2(g)+O2(g) △H= +Q kJ/mol
2SO2(g)+O2(g) △H= +Q kJ/mol
B.向20mL0.5mol·L-1FeBr2(aq)中通入224mL Cl2(标准状况):2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.以金属银为阳极电解饱和硫酸铜溶液 Cu2+ + 2H2O = 2Cu + O2↑+ 4H+
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
下列关说法正确的是
A.9.2克NO2气体中含有分子数目为0.2 NA
B.标准状况下,2.24升SO3 中含有氧原子数目为0.3NA
C.将40gNaOH固体溶于1L水中配成1mol/L的溶液
D.12g金刚石含有的共价键数为2NA,1mol甲醇中含有共价键的数目为5NA
查看答案和解析>>
科目: 来源: 题型:
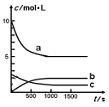
一定温度下,在体积为1L的恒容密闭容器中充入10 mol NO2和2.5 molO2发生反应:4NO2(g)+O2(g) ![]() 2N2O5(g) △H<0。反应混合物中NO2和物质的量浓度随时间的变化如下表所示:
2N2O5(g) △H<0。反应混合物中NO2和物质的量浓度随时间的变化如下表所示:
| t/s | 0 | 500 | 1000 | 1500 |
| c(NO2)/ mol ?L-1 | 10 | 7 | 5 | 5 |
(1)该反应的正反应是 ① (填“吸热”或“放热”)反应,其平衡常数表达式K= ② 。
(2)反应达到平衡时,NO2的转化率为 ① ,若要增大NO2的转化率,可采取的措施有 ② (填字母)
A.降低温度 B.充入氦气
C.再充入NO2 D. 充入O2
(3)右图中表示N2O5的浓度的变化曲线是 (填字母)
查看答案和解析>>
科目: 来源: 题型:
(1)(4分)在稀氨水中存在平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-。
NH4++OH-。
a、在稀氨水中,加入适量NaOH晶体时,c(OH-) ① (1分),c(NH4+) ② (1分)。
(填“增大”“减小”“不变”)
b、氨水是一种弱碱,在水中存在电离平衡:NH3·H2O![]() NH4++OH-,请写出
NH4++OH-,请写出
NH3·H2O电离平衡时的电离平衡常数表达式:Kb= (2分)。
(2)(4分)写出H2SO4和NaHCO3的电离方程式:
H2SO4:__(2分)、NaHCO3:___(2分)。
查看答案和解析>>
科目: 来源: 题型:
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和④探究温度对该 反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对 该反应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目: 来源: 题型:
现有可逆反应:A (g)+B(g)![]() 3C(g),下图中甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间的关系:
3C(g),下图中甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的百分含量(C%)和反应时间的关系:
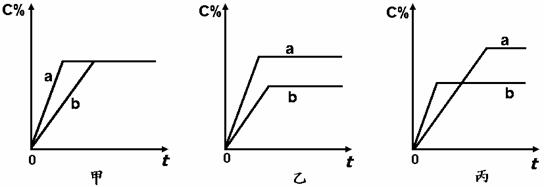
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则 曲线表示有催化剂的情况。
(2)若乙图中的a曲线分别表示200℃时的情况,b曲线表示100℃的情况,则此可逆反应的正反应是 (填“吸热反应”或“放热反应”)。
(3)若丙图中的两条曲线分别表示不同压强情况,则 曲线是表示压强较大的情况。
查看答案和解析>>
科目: 来源: 题型:
在水溶液中,橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O![]() 2CrO42-+2H+。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42-+2H+。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈 ① 色,因为 ② 。
(2)向已加入NaOH溶液的(1)溶液再加入过量稀H2SO4,则溶液呈 ① ,因为 ② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com