
科目: 来源: 题型:
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
粗CuO、
稀硫酸 水 3%H2O2 稀氨水 稀硫酸
![]()
![]()
![]()
![]()
![]()
![]()
![]() 溶解、 操作 加热 操作 搅拌 调pH 调pH 操作
溶解、 操作 加热 操作 搅拌 调pH 调pH 操作
![]()
![]()
![]()
![]()
![]()
![]() 过滤 Ⅰ Ⅱ 过滤 至1~2 Ⅲ
过滤 Ⅰ Ⅱ 过滤 至1~2 Ⅲ
滤渣Ⅰ 滤渣Ⅱ 胆矾
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是 ;
H2O2参加反应的离子方程式为 。
(2)加稀氨水调节pH的目的是 ,pH应调至 范围。
下列物质可用来替代稀氨水的是
①NaOH ②Fe2O3 ③CuO ④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括 、 、过滤、 、干燥等步骤。
查看答案和解析>>
科目: 来源: 题型:阅读理解
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3=-867kJ·mol-1
则△H2= 。
Ⅱ. 化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1) 将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为
C(s) + H2O(g) == CO(g) + H2(g)
该反应的化学平衡常数表达式为K= 。
800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
a加入催化剂 b降低温度 c缩小容器体积 d减少CO2的量
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
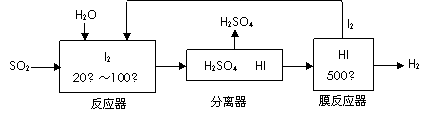 |
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是 。
Ⅲ.开发新能源是解决大气污染的有效途径之一。直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
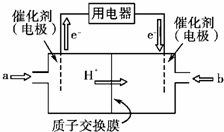
通入a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:
2NH3(g)+CO2(g) ![]() NH2COONH4(s)
NH2COONH4(s)
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH 0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式 。
(3)按下图装置进行如下实验:

步骤1:检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入足量的氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是 。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有 。
③以恒压滴液漏斗代替分液漏斗的目的是 。
④反应后期随着CO2气流减慢,导致反应物比例不当,可采取的相应措施是 。(4)有同学认为该实验装置存在安全问题,请问可能面临的安全问题是 。
查看答案和解析>>
科目: 来源: 题型:
草酸合铁(Ⅲ)酸钾晶体Kx[Fey(C2O4)z]·nH2O可用于摄影和蓝色印刷。为确定其组成,某化学兴趣小组在没有氧气干扰下进行如下实验:
实验Ⅰ.草酸根含量的测定
称取0.9820 g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358 K,用0.2000 mol·L-1 KMnO4溶液滴定,滴定过程中草酸根离子转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4溶液12.00 ml。
实验Ⅱ.铁含量的测定
将上述滴定过草酸根的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液做指示剂,用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液8.00 ml。(已知:实验Ⅱ中涉及的部分离子方程式为:I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题
(1)实验Ⅰ在滴定过程中反应的离子方程式为 。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则测定的Fe3+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)实验Ⅱ用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。
2C(g)。
|
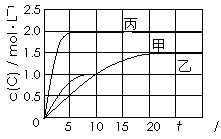 |
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1 ·min-1
B.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
C.由图可知:T1<T2,且该反应为放热反应
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
查看答案和解析>>
科目: 来源: 题型:
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl) < c[(NH4)2SO4] < c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
查看答案和解析>>
科目: 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热 | 未出现红色沉淀 | 葡萄糖中不含有醛基 |
| B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A. 常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
B.铅蓄电池在放电过程中,负极质量增加,正极质量减少
C.其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积
D.常温下,向饱和碳酸钠溶液中加入过量碳酸钡粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)< Ksp(BaSO4)
查看答案和解析>>
科目: 来源: 题型:
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结
构如右图,下列关于该物质的说法正确的是
A.其分子式为C15H18O4
B.分子中只含有1个手性碳原子
C.既能发生加聚反应,又能发生缩聚反应
D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色

查看答案和解析>>
科目: 来源: 题型:
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是
A. 元素B和E的氧化物对应的水化物均为强酸
B.C的单质能与A的氧化物发生置换反应
C.元素C、D、E的最高价氧化物对应的水化物之间均可相互反应
D.工业上常用电解元素C、D的氯化物来制取它们的单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com