
科目: 来源: 题型:
化学已渗透到人类生活的各个方面,下列说法正确的是
A.禁止使用四乙基铅作汽油抗爆震剂,可减少环境中的铅污染
B.为防止富脂食品氧化变质,常在包装袋中放入生石灰
C.铬是人体必需的微量元素,但铬过量会危害人体健康,其中六价铬的毒性最大。人体内六价铬超标,可以服用维生素C缓解毒性,说明维生素C具有氧化性
D.去年冬天的雾霾天气严重影响了人们的正常出行和生活节奏。为改善空气质量,可以加高工厂的烟囱,使烟尘和废气远离地表
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
回答下列问题:
(1)___________________________时段,反应处于平衡状态。
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是_____________;平衡向____________方向移动。(填“正”、“逆”或“不”)
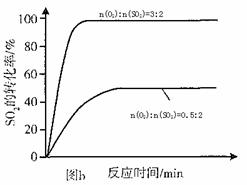
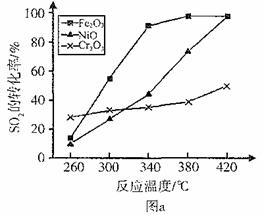
(3)其他条件相同、催化剂不同时,S02的转化率随反应温度的变化如图a。2600C_______ (填Fe203、Ni0或Cr203)作催化剂反应速率最快。Fe2O3和Ni0作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe203的 主要优点是_____________。
 | |||
 | |||
(4)科研小组在3800C Fe203作催化剂时,研究了不同投料比n(O2):n(SO2)
对S02转化率的影响,结果如图b。请在答题卡坐标图中画出n(O2):n(SO2)=1:2
时,SO2转化率的预期变化曲线。
查看答案和解析>>
科目: 来源: 题型:
氯气在298K、100kPa时,在1L水中可溶解0.090mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________________;
(2)根据离子方程式,计算该反应的平衡常数(水视为纯液体,列式计算,保留2位有效数字)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;(填“正”、“逆”或“不”)
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。(填“正”、“逆”或“不”)
(5)新制氯水经光照一段时间后溶液c(H+)增大,请运用平衡移动原理进行解释:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C-F | 427 | C-Cl | 330 | C-I | 218 |
H-H | 436 | S=S | 255 | H-S | 339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________ <C-Br键能<__________ (回答数值和单位)
(2)热化学方程式2H2(g)+S2(g) ==2H2S(g);△H= QkJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) == O+2(g) + e— ![]() H1= +1175.7 kJ·mol-1
H1= +1175.7 kJ·mol-1
PtF6(g) + e—== PtF6—(g) ![]() H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1
O2+PtF6—(s) == O2+(g) + PtF6—(g) ![]() H3= +482.2 kJ·mol-1
H3= +482.2 kJ·mol-1
则反应O2(g) + (g) = O2+PtF6— (s) ![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
回答下列问题:
(1)该反应的离子方程式为 。
(2)该实验的目的是 。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是 ,实验现象为 。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是 (填字母)。
A.温度 B.试剂的浓度 C.试剂的用量(体积) D.试剂添加的顺序
(5)由上述实验记录可得出的结论是 。
(6)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是 。
查看答案和解析>>
科目: 来源: 题型:
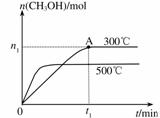
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)![]() CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
A.该反应的△H<0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t 1min内 CH3OH的平均生成速率为![]() mol·L-1 min-1
mol·L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平衡时![]() 减小
减小
查看答案和解析>>
科目: 来源: 题型:
在水溶液中,重铬酸钾K2Cr2O7存在以下平衡:![]()
![]()
![]() ,下列说法正确的是
,下列说法正确的是
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应不是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是![]()
查看答案和解析>>
科目: 来源: 题型:
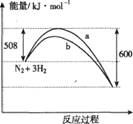
在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2![]() 2NH3 ΔH =-92 kJ·mol-1
2NH3 ΔH =-92 kJ·mol-1
B.达到平衡后向容器中通入1 mol氦气,平衡不移动
C.降低温度和缩小容器体积均可使该反应的平衡常数增大
D.右图中曲线b表示使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com