
科目: 来源: 题型:
下列关于浓H2SO4的叙述中正确的是( )
A.浓H2SO4具有吸水性,因而能使蔗糖炭化
B.浓H2SO4在常温常压下可迅速与铜片反应放出SO2气体
C.浓H2SO4是一种干燥剂,能够干燥NH3、H2等气体
D.浓H2SO4在常温下能够使铁、铝金属钝化
查看答案和解析>>
科目: 来源: 题型:
在医学、日常生活中常见的①福尔马林,②医用消毒酒精,③生理盐水,④食醋,这些溶液中溶质的质量分数由大到小的顺序是( )
A. ①②③④ B.②①③④ C. ②④①③ D. ②①④③
查看答案和解析>>
科目: 来源: 题型:
勤洗手是预防传染病的有效途径之一。某消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色。则该消毒液的主要成分可能是( )
A.KMnO4 B.H2O2 C.NaClO D.NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
在化学的发展史上,世界上许多科学家创建的理论对化学科学的发展起到重大的作用。下 列有关科学家及其创建的理论的描述中,错误的是( )
A.门捷列夫发现了元素周期律 B.道尔顿创立分子学说
C.拉瓦锡确立了质量守恒定律 D.勒沙特列发现化学平衡移动原理
查看答案和解析>>
科目: 来源: 题型:阅读理解
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式。
②由上表数据可知该反应为放热反应,理由是。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
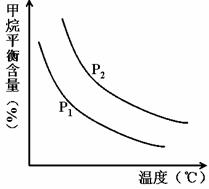 (2)原料气H2可通过反应 CH4(g) + H2O (g)
(2)原料气H2可通过反应 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为,该温度下反应的平衡常数K值为。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
科目: 来源: 题型:
如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
(1)B极是电源的________,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明__________________________,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是__________________________。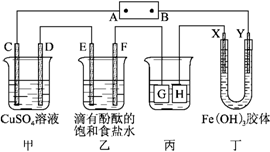
查看答案和解析>>
科目: 来源: 题型:阅读理解
常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c (HA) = c (NaOH) =0.lmol/L,测得混合后溶液的pH>7。
① 不能证明HA是弱电解质的方法是( )
A.测得0. 1mol/L HA的pH>lB.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
② 混合溶液中,关系式一定正确的是 ( )
A.c(A-)>c(Na+)c(OH-)>c(H+) B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L D.c( HA) +c( H+)=c(OH-)
③ 若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,
则相同pH的 ①NaA溶液 ②Na2B溶液 ③NaHB溶液 ④NaC溶液,其物质的量浓度由大到小的顺序为 (填序号)。
(2)若c( HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为 mol/L
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)= 0.04 mol/L,c(NaOH)==0.02 mol/L。
① 若HA为CH3COOH,该溶液显酸性,溶液中所有离子按浓度由大到小排列的顺序是 。
②若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为 mol/L(假设混合后溶液体积为两溶液体积之和)。
查看答案和解析>>
科目: 来源: 题型:
某现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,
请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)_。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是___。
(4)已知t℃时,Kw=1×10-13,则t℃(填“>”、“<”或“=”) ________25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
查看答案和解析>>
科目: 来源: 题型:
(1)对于Ag2S(s) ![]() 2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(2)下列说法不正确的是__________。
A. 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
B. 物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
C. 对于Al(OH)3(s) ![]() Al(OH)3(aq)
Al(OH)3(aq) ![]() Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
D. 除溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
E. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
(3)氯化铝的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):______。 实验室在配制氯化铝的溶液时,常将氯化铝固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(4)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com