
科目: 来源: 题型:
下列物质分类的正确组合是
| 混合物 | 化合物 | 单质 | 盐 | |
| A | 盐酸溶液 | NaOH溶液 | 石墨[来 | 食盐 |
| B | 水玻璃[ | KNO3晶体 | O3 | 纯碱 |
| C | 氢氧化铁胶体 | 澄清石灰水 | 铁 | 石灰石 |
| D | CuSO4·5H2O | CaCl2 | 水银 | CaO |
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A. 物质的量是衡量物质质量大小的物理量 B. 摩尔质量即相对分子质量
C. 摩尔是物质的量的单位 D. 气体摩尔体积是指单位物质的量的物质所占的体积
查看答案和解析>>
科目: 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
|
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O ![]() 2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)生成滤渣1中红褐色物质的反应的化学方程式是 。
滤液1的成分除Na2CrO4外,还含有(填化学式) 。
(2)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
(4)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、 、 、洗涤、干燥。
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
。
查看答案和解析>>
科目: 来源: 题型:
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
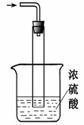
(1)如用右图装置制取氨气,选择的试剂可以是(填序号)
A.氯化铵固体与消石灰固体 B.浓氨水与碱石灰
C.浓氨水与NaOH固体 D.氯化铵溶液与烧碱溶液
(2)制备氨基甲酸铵的装置如下图,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。(注:四氯化碳与液体石蜡均为惰性介质)
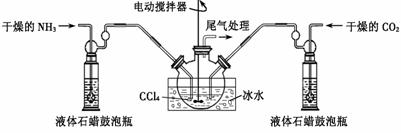
 ①发生器用冰水冷却的原因是________ __ _;液体石蜡鼓泡瓶的作用是______________________________ __。
①发生器用冰水冷却的原因是________ __ _;液体石蜡鼓泡瓶的作用是______________________________ __。
②尾气处理装置如右图所示。
双通玻璃管的作用: ;
浓硫酸的作用: 、________ _。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使所有碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为____________。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
查看答案和解析>>
科目: 来源: 题型:
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如右图。下列有关说法不正确的是
A.该一元碱溶液浓度为0.100 0 mol·L-1
B.a、b、c点的水溶液导电性依次增强
C.室温下,MOH的电离常数Kb=1×10-5
D.b点:c(M+)+c(MOH)=c(Clˉ)

查看答案和解析>>
科目: 来源: 题型:
某全钒新型电池,以惰性材料作电极,在电解质溶液中发生电池总反应为:
VO2+(蓝色)+H2O+V3+(紫色)![]()
![]() VO2+(黄色)+V2+(绿色) +2H+。下列说法正确的是
VO2+(黄色)+V2+(绿色) +2H+。下列说法正确的是
A.当电池无法放电时,只要更换电解质溶液,不用外接电源充电就可正常工作
B.放电时,负极反应为VO2++2H++e— ===VO2++H2O
C.充电时,阳极附近溶液由绿色逐渐变为紫色
D.放电过程中,正极附近溶液的pH变小
查看答案和解析>>
科目: 来源: 题型:
已知25℃时有关弱酸的电离平衡常数如下。下列有关说法正确的是
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
A.NaHCO3溶液中,一定有c(Na+)=c(HCO3—)+c(CO32—)
B.将amol?L—1HCN溶液与amol?L—1NaOH溶液等体积混合后,测得所得溶液显碱性(pH>7),则c(OH—)>c(H+),c(CN—)>c(Na+)
C.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
D.1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小
查看答案和解析>>
科目: 来源: 题型:
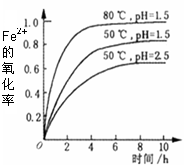
酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如右图所示。下列有关说法正确的是
A.该氧化过程的离子方程式为:
Fe2++O2+4H+===Fe3++2H2O
B.pH=1.5时Fe2+的氧化率一定比pH=2.5的大
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.其他条件相同时,80℃时Fe2+的氧化率比50℃的大

查看答案和解析>>
科目: 来源: 题型:
下列表格中的各种情况,可以用右图的曲线表示的是
| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, N2 + 3H2 | 氨气的浓度 | 活性高的 催化剂 | 活性一般的催化剂 |
| D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com