
科目: 来源: 题型:
下列萃取与分液结合进行的操作(用CCl4作萃取剂,从碘水中萃取碘)中错误的是( )
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器承接并保存上层液体
查看答案和解析>>
科目: 来源: 题型:
下列对实验操作的叙述错误的是( )
A.用胶头滴管加液时,不能伸入试管中
B.蒸馏盛在烧瓶中含水的酒精,需在瓶内放一些碎瓷片
C.温度计插入液体中测量温度的同时,又用它搅拌液体
D.用容积为100 mL的量筒量取80 mL无水乙醇,使液面最低点至刻80 mL处
查看答案和解析>>
科目: 来源: 题型:阅读理解
常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c (HA) = c (NaOH) =0.lmol/L,测得混合后溶液的pH>7。
① 不能证明HA是弱电解质的方法是( )
A.测得0. 1mol/L HA的pH>lB.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
② 混合溶液中,关系式一定正确的是 ( )
A.c(A-)>c(Na+)c(OH-)>c(H+) B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L D.c( HA) +c( H+)=c(OH-)
③ 若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,
则相同pH的 ①NaA溶液 ②Na2B溶液 ③NaHB溶液 ④NaC溶液,其物质的量浓度由大到小的顺序为 (填序号)。
(2)若c( HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为 mol/L
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)= 0.04 mol/L,c(NaOH)==0.02 mol/L。
① 若HA为CH3COOH,该溶液显酸性,溶液中所有离子按浓度由大到小排列的顺序是 。
②若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为 mol/L(假设混合后溶液体积为两溶液体积之和)。
查看答案和解析>>
科目: 来源: 题型:阅读理解
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式。
 ②由上表数据可知该反应为放热反应,理由是。
②由上表数据可知该反应为放热反应,理由是。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
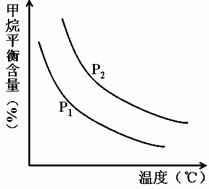
(2)原料气H2可通过反应 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为,该温度下反应的平衡常数K值为。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
科目: 来源: 题型:
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作完成问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动;另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶完后,溶液中[H+]/[CH3COOH]的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)。(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至
pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中
[Na+]、[CH3COO-]的大小关系为:[Na+]________[CH3COO-]。
(5)取25 mL的乙溶液,加入等体积pH=12的氨水,反应后溶液中的溶质为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com