
科目: 来源: 题型:
下列叙述正确的是
A.O2的摩尔体积约为22.4 L
B.1 mol CO2 的质量为44g/mol
C.不同物质的摩尔质量必定不相等
D.50mL溶液中,2mol·L-1 NaCl溶液和1 mol·L-1 CaCl2 溶液中的c(Cl-)相等
查看答案和解析>>
科目: 来源: 题型:
下列实验能达到预期目的的是
A.用酒精萃取碘水中的碘 B.将气体通过灼热CuO以除去O2中混有的H2
C.用分液法分离花生油和水 D.海盐经过溶解、过滤、蒸发制纯净的NaCl
查看答案和解析>>
科目: 来源: 题型:
对下列事故处理方法错误的是
A.金属钠着火,立即用泡沫灭火器灭火
B.洗发水流入眼内,立即用大量水冲洗Ks5u
C.不小心把250mL的小罐油漆引燃,立即用湿毛巾盖灭
D.浓硫酸溅到皮肤上,立即用干净的布轻轻拭去,并用大量的水冲洗
查看答案和解析>>
科目: 来源: 题型:
如图,p、q为直流电源的两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D极上均产生气泡。试回答:
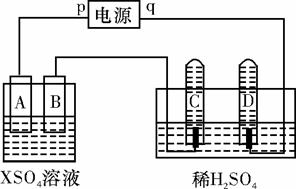
(1)p为 极,A极发生了 反应。
(2)C为 极,试管里收集到的气体是 。
(3)C极的电极反应式是 。
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积 (cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体体积 (cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,造成阴、阳两极气体体积比变化的可能原因
是 。
(5)当反应进行一段时间后,A、B电极所在的电解池中溶液的pH (填“增大”、“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为 。
查看答案和解析>>
科目: 来源: 题型:
锂离子电池已经成为第一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为:
负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);
正极反应:Li1-xMO2+xLi++xe-===LiMO2(LiMO2表示含锂的过渡金属氧化物)。
下列有关说法正确的是
A.锂离子电池充电时电池反应为LiMO2+C6Li1-x===C6Li+Li1-xMO2
B.电池反应中,锂、锌、银、铅各失去1 mol 电子,金属锂所消耗的质量最大
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi+-xe-===C6Li
查看答案和解析>>
科目: 来源: 题型:
目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能。所用的原料仍然是Pb-PbO2-H2SO4,下列关于该铅酸蓄电池的说法正确的是
A.充电时,电源的正极接蓄电池标“+”的一极,电池上标有“-”的一极发生氧化反应
B.“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理
C.放电时,在铅酸蓄电池的负极发生还原反应
D.若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12 L Cl2,电池内至少消耗H2SO4 0.10 mol
查看答案和解析>>
科目: 来源: 题型:
1 L 0.1 mol·L-1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16 g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)
A.转移的电子数是1.204×1022
B.阳极上产生112 mL O2(标准状况)
C.溶液的浓度变化为0.08 mol·L-1
D.反应中有0.01 mol Ag被氧化
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液中加入0.1 mol碱式碳酸铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH。下列有关叙述不正确的是
A.电解过程中只发生了反应:2CuSO4+2H2O2Cu+O2↑+2H2SO4
B.电解过程中转移的电子数为3.612×1023
C.电解过程中产生的气体体积(在标准状况下)为5.6 L
D.加入碱式碳酸铜的反应是:
Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com