
科目: 来源: 题型:
反应A2(g)+2B2(g)![]() 2AB2(g)的ΔH<0,下列说法正确的是( )
2AB2(g)的ΔH<0,下列说法正确的是( )
A.升高温度,正反应速率增加,逆反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
把1.0 mol·L-1 CuSO4和0.50 mol·L-1 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1) 混合溶液中CuSO4和H2SO4的物质的量浓度c(CuSO4)=_______ c(H2SO4)=_________
(2)混合液中H+、SO42-的物质的量浓度c(H+)=__________ c(SO42-)=_________
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中Fe2+的物质的量浓度c(Fe2+)=___________________________
查看答案和解析>>
科目: 来源: 题型:
我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体,应选用下列装置中的 。
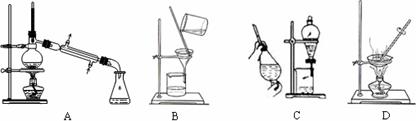
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl—和NH4+,实验室鉴定Cl—所选用的试剂是 、 ,鉴定另一种杂质离子的方法是 (填序号)。
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,滴入酚酞试剂
D.加氢氧化钠溶液,加热,滴入紫色石蕊试剂
(3)碳酸氢钠晶体受热分解可得到纯碱,其化学反应方程式为
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质。
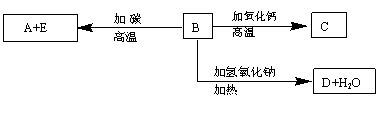
请填空:
(1)形成单质A的元素,在化合物中的最高化合价为 。
(2)B和碳反应生成A和E的化学方程式是 。
(3)C的化学式为 ,D 的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
以下是对重要非金属及其化合物的讨论,根据要求回答问题:
(1)实验室盛装NaOH溶液是试剂瓶不能用玻璃塞,应该用橡胶塞,以防止发生反应:
(离子方程式)。
(2)氨是一种重要的化工产品,密度比空气 (填“大”或“小”)。工业上制备氨气的化学方程式为 。
(3)工业上制取漂白粉的反应化学方程式为 。
(4)浓H2SO4常用作气体干燥剂,是因为它具有____________;将适量的蔗糖放入烧杯中,滴入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
产生刺激性气味气体的化学方程式为 。
(5)铜和稀硝酸反应的离子方程式是 。若参加反应的Cu质量为6.4g,生成NO气体____________L(标准状况下),则转移电子物质的量为 mol,被还原的与未被还原的HNO3物质的量之比为 。
查看答案和解析>>
科目: 来源: 题型:
以下是对金属及其化合物的讨论,根据要求回答问题
(1)写出钠与水反应的离子方程式 。
(2)在AlCl3溶液中逐滴滴入过量的NaOH溶液,观察到的现象是 ,
反应的离子方程式为 , 。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为 。
查看答案和解析>>
科目: 来源: 题型:
下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
A.Fe2O3跟稀硝酸反应
B.铜跟稀硝酸反应
C.CuO跟稀硝酸反应
D.Al(OH)3跟稀硝酸反应
查看答案和解析>>
科目: 来源: 题型:
NA代表阿伏加德罗常数。下列有关NA的叙述中,正确的是( )。
A.1 mol 任何物质所含的分子数均为NA
B.14 g氮气所含的氮原子数为NA
C.标准状况下,22.4 L水所含的水分子数为NA
D.在钠与氯气的反应中,1 mol钠失去电子的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式中,书写正确的是( )。
A.钾跟水反应 2K+2H2O=2K++2OH-+H2↑
B.铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑
C.氢氧化钙溶液跟碳酸反应 Ca2++CO32-=CaCO3↓
D.碳酸钙跟盐酸反应 CO32-+2H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com