
科目: 来源: 题型:
A、B、C是三种短周期元素,它们的原子序数依次增大。A元素原子形成的离子就是一个质子;C元素是地壳中含量最多的元素;B元素的两种气态氧化物以等物质的量混合后,气体的平均相对分子质量为36。
回答下列问题:
(1)写出B元素的符号 。
(2)将3.6g B单质在足量C单质中完全燃烧,所得气体通入1L 0.4 mol/L的NaOH溶液,完全吸收。此过程用一个离子方程式可表示为 。
(3)A元素的单质与C元素的单质可制成化学电源——燃料电池,电池以浓氢氧化钠溶液为电解液,以惰性金属为电极,则通入A单质的一极为电池 极,该电极的电极反应式为
。通入C单质的一极为电池的另一个电极,其电极反应式为
。已知每生成1 mol液态A2C放出286kJ热量,写出该电池工作原理的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题:
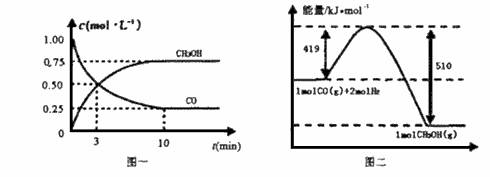
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= 。
(2)写出该反应的热化学方程式 。
n(CH3OH)
(3)恒容条件下,下列措施中能使 n(CO) 增大的有 。
A.升高温度 B.充入He气 C.再充入1 mol CO和2 mol H2 D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化(Q1、Q2、Q3均大于0) |
| 甲 | 1 mol CO和2 mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1 mol CH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2mol CO和4 mol H2 | a3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是:
A. c1=c2 B.2Q1=Q3 …… C.2a1=a3 D. a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是
。
查看答案和解析>>
科目: 来源: 题型:
已知下列反应的平衡常数:
H2(g)+ S(s)=H2S(g) K1
S(s) + O2(g)=SO2(g) K2
则反应H2(g)+ SO2(g)=O2(g) + H2S(g)的平衡常数是:
A. K1+ K2 B. K1- K2 C. K1/K2 D. K1×K2
查看答案和解析>>
科目: 来源: 题型:
已知:H2的燃烧热为285.8 KJ·mol-1,CO的燃烧热为282.8 KJ·mol-1,现有CO、H2和CO2组成的混合气体112.0L(标准状况),经完全燃烧后放出总热量为851.4KJ,并产生18g 液态水,则燃烧前混合气体中CO的体积分数是:
A.80% B.40% C.60% D.20%
查看答案和解析>>
科目: 来源: 题型:
已知:2Zn(s) + O2(g)=2ZnO(s) △H = -701.0 KJ·mol-1
2Hg(l)+ O2(g)=2HgO(s) △H = -181.6 KJ·mol-1
则反应Zn(s) + HgO(s)=ZnO(s) + Hg(l)的△H为:
A. +519.4 KJ·mol-1 B. +259.7 KJ·mol-1
C. -519.4 KJ·mol-1 D. -259.7 KJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是:
A.少量铁粉投入稀硫酸中:2Fe+ 6H+=2Fe3+ + 3H2↑
B.混合NaHCO3溶液与Al2(SO4)3溶液:3HCO3- +Al3+=Al(OH)3↓+ 3CO2↑
C.铜投入FeCl3溶液中:3Cu + 2Fe3+=2Fe + 3Cu2+
D.硫酸亚铁溶于水:Fe2++ 2H2O=Fe(OH)2↓+ 2H+
查看答案和解析>>
科目: 来源: 题型:
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,现取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀平衡时,测得溶液的pH=13,则下列说法不正确的是:
A.所得溶液中由水离出的C(OH -)=1.0×10-13 mol·L-1
B.所加烧碱溶液的pH=13
C.所得溶液中C(Mg 2+)=5.6×10-10 mol·L-1
D.在整个反应过程中,H2O的电离度在逐渐减小
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解1L某浓度的NaCl溶液,假计产生的气体完全逸出,一段时间后停止电解,此时若加入100g 36.5%的浓盐酸,所得溶液恰好与原溶液完全相同。下列说法正确的是:
A.电解过程中,阴、阳两极产生的气体体积相同(同温同压)
B.电解后加盐酸前溶液中C(NaOH)=1mol·L-1
C.电解过程中,转移电子的物质的量约为8mol
D.原溶液中含有117g NaCl
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各溶液中微粒的物质的量浓度关系正确的是:
A.0.1mol·L-1的Na2CO3溶液中:2C(Na+)=C(CO32-)+ C(HCO3-)+ C(H2CO3)
B. pH=2的盐酸与pH=12的氨水等体积混合:C(NH4+)=C(Cl-) > C(H+)=C(OH-)
C. pH=11的Na2CO3溶液中:C(Na+)-2C(CO32-)-C(HCO3-)=10-3-10-11
D.浓度分别为0.1mol·L-1和0.01mol·L-1的CH3COOH溶液中:C(CH3COO-)前者为后者的10倍
查看答案和解析>>
科目: 来源: 题型:
已知电离平衡常数:H2CO3>HClO> HCO3-,氧化性:HClO > Cl2 >Br2> Fe3+>I2。下列有关离子反应的叙述中正确的是:
A.能使pH试纸显深红色的溶液中, Fe3+、Cl-、Ba2+、Br-能大量共存
B.向溴水中加入足量FeCl2溶液能使溶液变成无色
C.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO- + CO2 + H2O=2HClO+CO32-
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为: 2Fe2++ Cl2=2Fe3+ + 2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com