
科目: 来源: 题型:
下列说法中,正确的是
A.酸性高锰酸钾溶液具有强的氧化性,配制时用盐酸酸化
B.用25.00mL碱式滴定管量取20.00mL酸性高锰酸钾溶液
C.将KI溶液滴入酸性KMnO4溶液中,溶液的紫色能褪去
D.将SO2通入酸性高锰酸钾溶液,溶液紫色褪去,是SO2漂白性的表现
查看答案和解析>>
科目: 来源: 题型:
下列过程属于化学变化的是:①白色的硫酸铜粉末久置于空气中变成蓝色;②福尔马林用来浸制标本;③同素异形体之间的互变;④同分异构体之间的互变;⑤蜂蚁叮咬处涂稀氨水或小苏打溶液可减轻痛苦;⑥核裂变
A.只有②③④⑤ B.只有③④⑤ C.只有①②③④⑤ D.全部
查看答案和解析>>
科目: 来源: 题型:
下列有关说法中,不正确的是
A.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关
B.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
C.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
D.焰火的五彩缤纷是某些金属元素的性质的展现
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______ V2 (填“>”、“=”或“<”),中和后所得溶液中离子浓度由大到小的顺序为 。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2 (g) ![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8g,则用H2表示该反应的反应速率为_____。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池。氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(I)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。写出其正极电极反应式 。
(II)以上述电池为电源,石墨为电极电解1L 0. 1mol/L的氯化钾溶液。回答下列问题:
(1)写出电解总反应的离子方程式 。
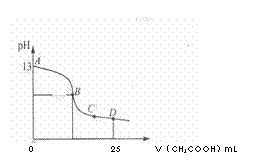
(2)室温时,电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸,加入醋酸的体积与溶液的pH的关系如图所示(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①计算消耗标准状况下甲烷 mL。
②若图中的B点pH=7,则酸碱恰好完全反应的点在 区间(填“AB”、“BC”或“CD”)。
③AB区间溶液中各离子浓度大小关系中可能正确的是 。
A. c(K+)>c(OH-)>c (CH3COO-) >c(H+)
B. c(K+)>c(CH3COO-)>c(OH-) >c(H+)
C. c(K+)>c(CH3COO-)=c(OH-) >c(H+)
查看答案和解析>>
科目: 来源: 题型:
亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2 的作用,若缺铁就可能出现缺铁性贫血。下面是一种常见补铁药品说明书中的部分内容:该药品含Fe2+ 33%—36%,不溶于水但能溶于人体中的胃酸;与Vc(维生素C)同服可增加本品吸收。
Ⅰ.甲同学设计了以下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:
![]()
⑴加入新制氯水后溶液中发生的离子反应方程式是_____________、 。
⑵加入KSCN后溶液变淡红色,说明溶液中有少量Fe3+。该离子存在的可能原因___________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在实验过程中有少量二价铁被氧化 C.药品储存过程中有少量三价铁生成
⑶向血红色溶液中加入一片Vc片,片刻后溶液血红色褪去,说明Vc有 性。
Ⅱ.乙同学采用酸性高锰酸钾标准液滴定法测定该药品是否合格,原理:5Fe2++8H++MnO4-=5Fe3++2Mn2++4H2O 。准确称量上述药品10.00g,将其全部溶于试剂2,配成1000mL溶液,取出20.00mL,用0.0200 mol·L-1的KMnO4 溶液滴定,用去KMnO4溶液12.00 mL.
⑷该实验中的试剂2与甲同学设计实验中的试剂1都可以是 (填编号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
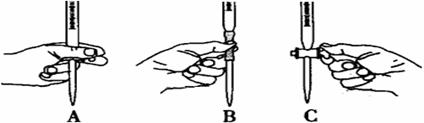
⑸本实验滴定过程中操作滴定管的图示正确的是 (填编号)。
⑹判断实验到达滴定终点的现象为 。
(7)经计算该药品中铁元素的百分含量为 。
查看答案和解析>>
科目: 来源: 题型:
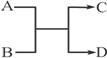
已知A 、B、C、D之间的转化关系如右图所示。下列说法正确的是
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,
则D常温下一定呈液态
查看答案和解析>>
科目: 来源: 题型:
某密闭容器中充入等物质的量的 A 和 B,一定温度下发生反应 A(g)+ xB(g) ![]() 2C(g),达到平衡后,在 30min 和 40min 时分别只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示,下列说法正确的是
2C(g),达到平衡后,在 30min 和 40min 时分别只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示,下列说法正确的是
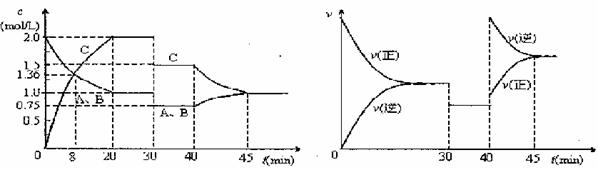
A.30min 时可能加入了催化剂
B.30min 时可能增大了容器的体积
C.30min 时可能降低温度,40min 时可能升高温度
D.反应方程式中的 x=1,正反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
已知25 ℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在5 mL含有KCl和KI各为0.01 mol/L的溶液中,逐滴加入5 mL0.01 mol/L AgNO3溶液形成浊液,下列叙述正确的是ks5u
A.先生成AgCl沉淀,再生成AgI沉淀 B.AgI的溶度积(Ksp)为1.23×10-10
C.浊液中Cl-和I-浓度之比约为1.03×106
D.如果不考虑水的蒸发,升高温度,则浊液中沉淀的质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com