
科目: 来源: 题型:
下列情况会对人体健康造成较大危害的是(▲)
A.自来水中通入少量Cl2进行消毒杀菌
B.用SO2漂白食品
C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D.用小苏打发酵面团制作馒头
查看答案和解析>>
科目: 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l)+2N2O4 (l)=2CO2 (g)+3N2(g)+4H2O(g) (Ⅰ)![]()
(1)反应(Ⅰ)中氧化剂是_______.
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) ![]() 2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.
2NO2 (g) (Ⅱ) 一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1)
查看答案和解析>>
科目: 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH![]() )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH![]() )。
)。
(3)如图是0.1 mol·L-1四种电解质溶液的pH随温度变化的图像。
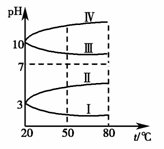
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),导致pH随温度变化的原因是____________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。(计算精确值)
)-3c(Al3+)=________。(计算精确值)
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________。
查看答案和解析>>
科目: 来源: 题型:
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。

试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。
(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目: 来源: 题型:
工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)![]() 4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)![]() 2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。一定浓度的硫化钠溶液因向空气中释放臭味而称为“臭碱”,下列对这一现象的解释你认为最合理的是 (填序号)
A.硫化钠在水溶液中水解生成了NaOH和H2S气体
B.硫化钠溶液因吸收空气中的氧气被氧化生成了NaOH,同时生成有臭味的气体
C.硫化钠溶液水解的过程中因吸收空气中的CO2而放出H2S气体
(2)向同物质的量浓度BaCl2和KBr混合溶液中逐滴加入AgNO3溶液,先生成 沉淀,当![]() = 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且![]() 会 (填变大、变小、始终不变)。
会 (填变大、变小、始终不变)。
[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)![]() 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
查看答案和解析>>
科目: 来源: 题型:
依据甲、乙、丙三图回答下列问题:
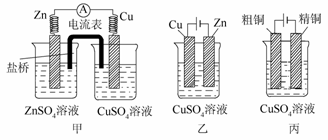
(1)甲装置为__________,乙装置为__________,丙装置为__________。
(2)甲、乙装置中,锌极上分别发生__________反应、__________反应。
(3)乙装置中,Cu2+浓度__________。
查看答案和解析>>
科目: 来源: 题型:
今有室温下四种溶液,有关叙述不正确的是
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.已知醋酸铵溶液呈中性,在①、②两中分别加入适量的氯化铵晶体或醋酸铵晶体后,两溶液的pH均减小
B.四种溶液分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.VaL④溶液与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb= 11∶9
查看答案和解析>>
科目: 来源: 题型:
臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示,下列有关说法不正确的是
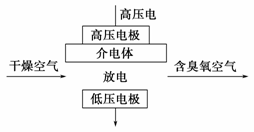
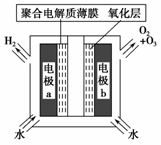
A.高压放电法,反应的原理为3O2====2O3
B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C.电解时,电极b周围发生的电极反应有3H2O-6e-=O3↑+6H+和2H2O-4e-=O2↑+4H+
D.电解时,H+由电极a经聚合固体电解质膜流向电极b
查看答案和解析>>
科目: 来源: 题型:
t℃时,在一密闭容器中充入2mol A和3mol B,发生如下化学反应:aA+B![]() C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
C+B(反应物、产物均为气体)平衡后测知各物质浓度有如下关系:{c(A)}a·c(B)=c(C)·c(D)然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则这时B的转化率是
A. 60% B.40% C.50% D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com