
科目: 来源: 题型:解答题
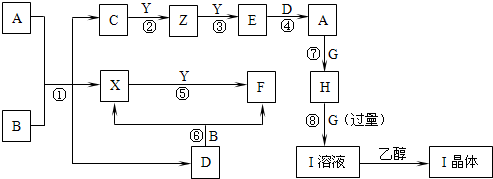
查看答案和解析>>
科目: 来源: 题型:单选题
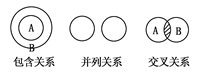
查看答案和解析>>
科目: 来源: 题型:解答题
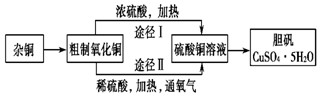
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 | |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目: 来源: 题型:解答题
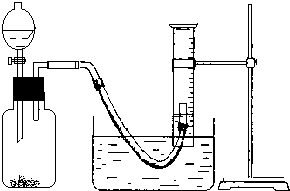 用Ag混有氧化钠的过氧化钠固体混合物制取氧气并测定其中过氧化钠的纯度(可供选择的反应物还有:蒸馏水),试回答下列问题:
用Ag混有氧化钠的过氧化钠固体混合物制取氧气并测定其中过氧化钠的纯度(可供选择的反应物还有:蒸馏水),试回答下列问题:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com