
科目: 来源: 题型:单选题
| 选项 | 分类目标 | 分类标准 | 分类结果 |
| A | 化学反应 | 有无离子参加或生成 | 离子反应和非离子反应 |
| B | 有无单质参加或生成 | 氧化还原反应和非氧化还原反应 | |
| C | 化学物质 | 分散质粒子大小 | 胶体、溶液和浊液 |
| D | 化合物在水溶液或熔融状态下能否导电 | 电解质和非电解质 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 | |
| 1 | 用试管取少量澄清石灰水备用,用另一试管取少量样品,再______ | 若无气体放出且澄清石灰水未见浑浊,则假设一成立; |
| 2 | ______ | ______ |
| ③ | ______ | ______ |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
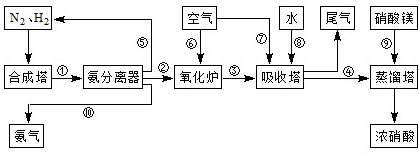
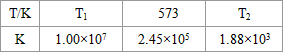
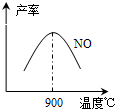 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因______.
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因______.查看答案和解析>>
科目: 来源: 题型:单选题
 NO2生成
NO2生成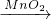 2H2SO4
2H2SO4查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com