
科目: 来源: 题型:单选题
 如图所示,A处通入湿润的Cl2,关闭B阀时,C处干燥的红布看不到明显现象,当打开B阀后,C处干燥的红布条逐渐褪色,则洗气瓶D中装的是
如图所示,A处通入湿润的Cl2,关闭B阀时,C处干燥的红布看不到明显现象,当打开B阀后,C处干燥的红布条逐渐褪色,则洗气瓶D中装的是查看答案和解析>>
科目: 来源: 题型:解答题
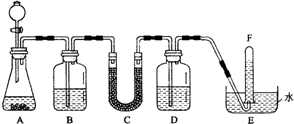 在潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可用于制取氧气.
在潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可用于制取氧气.| 仪器编号 | 盛放的试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D | 吸收未反应的CO2气体 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
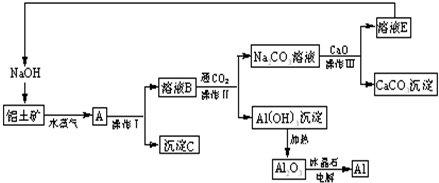
查看答案和解析>>
科目: 来源: 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 在溴乙烷中滴加硝酸银溶液 | 有白色沉淀出现 | 溴乙烷分子中含有溴原子 |
| C | 定容时不小心加水超过容量瓶的刻度线,立即用滴管吸去多余的部分 | 液体凹液面与刻度线相平 | 配制溶液的浓度不受影响 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com