
科目: 来源:2012届浙江省东阳中学高三上学期期中考试化学试卷 题型:单选题
a mol FeS投入到足量的稀硝酸中全部溶解,反应的方程式为:
FeS+HNO3 →Fe(NO3)3+H2SO4+NO↑+H2O (未配平),则下列说法正确的是
| A.反应中有3a mol的电子转移 | B.参加反应的HNO3为9a mol |
| C.氧化产物只有Fe(NO3)3 | D.被还原的HNO3为3a mol |
查看答案和解析>>
科目: 来源:2011-2012学年江西省赣州市(十一县市)高一上学期期中联考化学试卷 题型:单选题
一定条件下硝酸铵受热分解的方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为
| A.5∶3 | B.5∶4 | C.1∶1 | D.3∶5 |
查看答案和解析>>
科目: 来源:2012届江西省吉安一中高三上学期期中考试化学试卷 题型:单选题
某反应中有六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+,已知氧化性Co2O3>Cl2。下列叙述不正确的是( )
| A.氧化产物为Cl2 |
| B.微粒的还原性Cl->Co2+ |
| C.氧化剂与还原剂的物质的量之比为1:6 |
| D.若有3mol H2O生成,则反应中有2mol电子转移 |
查看答案和解析>>
科目: 来源:2012届上海市松江二中高三上学期期中考试化学试卷 题型:单选题
氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3 → 3O2↑+ 2Cl2↑+ 4HClO4 + 2H2O。根据题意完成第27~30题:
27.在上述变化过程中,发生还原反应的过程是:___________→___________(填化学式)。
28.该反应的氧化产物是______________(填化学式);所得混合气体的平均式量为_______。
29.已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,有关离子反应方程式为:
。
30.在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1升,测得溶液的pH = 2,则在反应中转移电子的物质的量为 mol。
查看答案和解析>>
科目: 来源:2012届河南省郑州市四十七中高三上学期第一次月考化学试卷 题型:单选题
有时候,将氧化还原反应方程式拆开写成两个“半反应”。下面是一个“半反应”式:MnO+____H++____e-——____Mn2++____H2O
该反应方程式的配平化学计量数是( )
| A.1,8,4,1,4 | B.2,16,5,2,8 | C.1,6,5,1,3 | D.1 ,8,5,1,4 ,8,5,1,4 |
查看答案和解析>>
科目: 来源:2012届高三上学期化学一轮复习《硫、氮和可持续发展》专题综合测试(苏教版) 题型:单选题
较活泼的金属锌与不同浓度的HNO3反应时,可得到不同价态的还原产物。如果起反应的锌和HNO3的物质的量之比为4 ∶10,则HNO3的还原产物可能为( )
| A.NO2 | B.NO | C.N2O | D.NH4NO3 |
查看答案和解析>>
科目: 来源:2010—2011学年福建省安溪一中、养正中学高二下学期期末联考化学试卷(理) 题型:单选题
金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式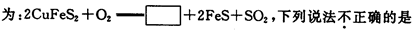
| A.方框中的物质应为 Cu2S | B.若有1 molSO2 生成,则反应中有4 mol 电子转移 |
| C.SO2既是氧化产物又是还原产物 | D.O2只作氧化剂 |
查看答案和解析>>
科目: 来源:2010—2011学年度安徽省马鞍山市高一第二学期期末测试化学试卷 题型:单选题
实现下列变化,一定要加入氧化剂的是
| A.HCl→Cl2 | B.Na2SO3→SO2 | C.HCl→H2 | D.HNO3→NO |
查看答案和解析>>
科目: 来源:2010—2011学年江苏省扬州市安宜高中高一上学期期末考试化学试卷 题型:单选题
下列反应中,属于氧化还原反应的是
A.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
B.2Al(OH)3 Al2O3+3H2O Al2O3+3H2O |
| C.FeO+2HCl= FeCl2+H2O |
| D.CuCl2+2NaOH=Cu(OH)2↓+2NaCl |
查看答案和解析>>
科目: 来源:2011届福建省龙岩市高三上学期期末化学卷 题型:单选题
已知Cl2和热的NaOH溶液反应生成NaClO3、H2O、X,则X为 ( )
| A. NaCl | B. NaClO4 | C. ClO2 | D. NaClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com