
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: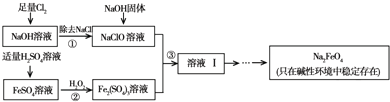
查看答案和解析>>
科目: 来源: 题型:解答题
某课外小组设计如图1所示装置进行探究实验(夹持装置已略去).
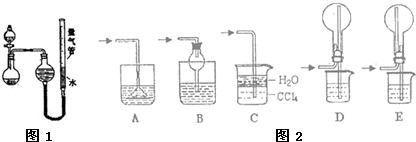
(1)实验过程中,使用分液漏斗滴加液体的操作是______.
(2)利用该装置抽取氨气并测量其体积,请回答下列有关问题.
①反应前,烧瓶中可加入的试剂是______,量气装置中的液体最好换用______(填字母编号).
a.稀NaOH溶液;b.CaO;c.煤油;d.氯化铵溶液;e.NaOH固体;f.氨水.
②该实验剩余的NH3需吸收处理.如图2所示的各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有______(填字母编号).
③本实验就对量气管多次读数,读数时应注意:Ⅰ.将实验装置恢复到室温;Ⅱ.______;Ⅲ.视线与凹液面最低处相平.
(3)该小组同学欲利用NH3、CO2和NaCl溶液模拟工业制碱,则在饱和NaC1溶液中通入气体的顺序依次为______,其反应的化学方程式为______.
(4)某同学认为利用上述所设计的装置也可进行铜与稀硝酸的反应,通过收集并测量NO气体的体积以测定铜的纯度.你认为______(填“可行”或“不可行”),理由是______.
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
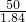 ml
ml查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
某小组同学欲研究SO2的性质.
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是______.
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用如图所示的装置研究SO2的性质:
(熔点:SO2 76.1℃,SO3 16.8℃;沸点:SO2 10℃,SO3 45℃)
①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是______.
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是;装置III中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是______.
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL 2.5mol?L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com