
科目: 来源: 题型:解答题
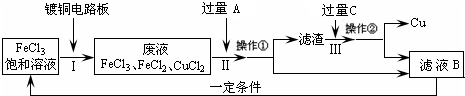
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:用量筒取样品溶液2mL于试管中,再滴加足量的2mol/L盐酸,充分振荡,观察 | 若______,则假设1可能成立;若______,则______. |
| 步骤2:往步骤1 的试管中加入______,充分振荡,观察 | ______ |
查看答案和解析>>
科目: 来源: 题型:解答题
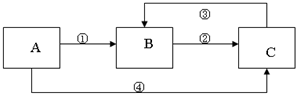
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


 (摩尔比)对NaHCO3产率的影响.实际生产中选择
(摩尔比)对NaHCO3产率的影响.实际生产中选择 =1.2.
=1.2.查看答案和解析>>
科目: 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 |
| 沉淀的pH范围 | 1.5-4.1 | 9.4-12.4 | 3.3-5.2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com