
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
| 物质 | 所含杂质 | 所用试剂 | 方法 | |
| A | O2 | CO2 | NaOH溶液 | 洗气 |
| B | FeSO4 | CuSO4 | Fe | 过滤 |
| C | 酒精 | 水 | CaO | 蒸发 |
| D | KCl | K2CO3 | 盐酸溶液 | 蒸发 |
查看答案和解析>>
科目: 来源: 题型:单选题
 1L某混合溶液.可能含有的离子如下表:
1L某混合溶液.可能含有的离子如下表:| 可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
查看答案和解析>>
科目: 来源: 题型:解答题
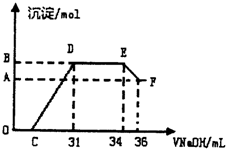
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目: 来源: 题型:单选题
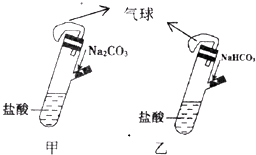 有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | C2H5OH (H2O) | 新制生石灰 | 蒸馏 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
 Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);
Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com