
科目: 来源:2010年河南省许昌市四校2011届高三上学期第一次联考(化学) 题型:填空题
某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,由于腐蚀,其标签已破损(如图:标签上部的化学式和下部的名称都不完整),根据前几天做过的实验判断,它是中学化学中常见的溶液。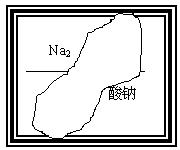
请根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计最简单的实验进行验证。
(1)下列物质中( )有可能是这瓶溶液的溶质
A 氯酸钠 B 磷酸二氢钠 C 硝酸钠 D 硫酸钠
(2)请将你的所有可能的推测,并取溶液少许加入一种试剂进行验证,把实验操作、现象和结论填在下表中(不一定填满):
| 推测(写化学式) | 依据的实验操作(加入验证试剂)、现象和结论 |
| 例: Na2SiO3 | 加入盐酸,若只有白色沉淀生成者为硅酸钠溶液 |
| ①: | |
| ②: | |
| ③: | |
| ④: | |
查看答案和解析>>
科目: 来源:吉林省长春市十一高中2010-2011学年度高三上学期期中考 题型:填空题
如图表示往某Na2CO3溶液中滴入盐酸及产生CO2的过程: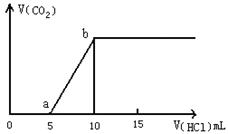
(1)写出a点以前发生反应的化学方程式 ;
(2)若加酸至图像处于a点时,再向溶液中加入Al3+溶液,则发生反应的离子方程式为
;
(3)若加酸至图像处于b点时,用惰性电极电解该溶液的总反应方程为 ___
;
当两极生成气体的体积均是1.12L(标准状况下)时,加入 mol (填名称)恰好将原溶液复原;
(4)若某溶液中含1 mol NaHCO3,滴入一定量的稀NaOH,恰好使溶液中Na+ 和HCO3-的物质的量之比为2:1,则滴入的NaOH的物质的量为 mol。
查看答案和解析>>
科目: 来源:福建省厦门双十中学2011届高三第一次月考化学试题 题型:填空题
(18分)
|

 ;
;查看答案和解析>>
科目: 来源:2010年江苏省泰兴市重点中学高三上学期第一次检测化学试题 题型:填空题
(10分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2).导电乙炔黑(一种炭黑).铝箔以及有机粘接剂。某回收工艺流程如下: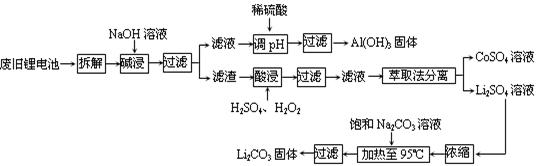
(1)上述工艺回收到的产物有 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是_______________。
(3)碱浸时主要反应的离子方程式为_____________________。
(4)酸浸时反应的化学方程式为___________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是_______________。
(5)生成Li2CO3的化学反应方程式为____________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应____________。
查看答案和解析>>
科目: 来源:2010年山西省河津二中高三上学期9月月考化学试题 题型:填空题
(5分)标准状况下,向100mLNaOH溶液中慢慢通入CO2气体充分反应后,在所得溶液M中逐滴加入1mol/L盐酸,(反应前后溶液体积变化忽略不计)所得气体体积和所加盐酸的体积关系如图。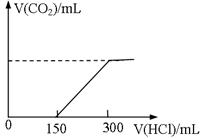
(1)c(NaOH)=
(2)取M溶液40mL与等体积的1mol/L盐酸按各种可能方式混合,产生气体的体积为VmL,则V的取值范围为 。
查看答案和解析>>
科目: 来源:江苏省2011届高三化学一轮过关测试(9) 题型:填空题
(6分)通常用小苏打的悬浊液除去CO2中的HCl,反应的离子方程式为:
,
不能用NaOH溶液的原因是 ,
也不能用NaCO3的原因是 (用离子方程式表示原因)
查看答案和解析>>
科目: 来源:新课标2010-2011学年度上学期高三一轮复习单元测试2(新人教) 题型:填空题
已知碱金属的氧化物有:普通氧化物,如Li2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三者均能与H2O或CO2反应产生O2。
(1)宇航工业,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的探索,有的科学家提出了“金属过氧化物处理系统”。即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。有关反应的化学方程式为 、 ;将处理后的气体充入座舱时,为了能保持飞船座舱内空气成分的稳定,还应采取的措施是___________________________________。
(2)人体内O2—离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: O2— + H2O = H2O2+ O2+
(3)Na2O2、K2O2、CaO2以及Ba O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(4)高温下,超氧化钾晶体 呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为
呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为 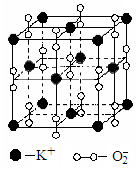
查看答案和解析>>
科目: 来源:09~10年内蒙牙林三中高二下学期期末考试化学卷 题型:填空题
(6分)钠、铝两种金属的单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属对应的氢氧化物中,具有两性的物质是 (填化学式),由此说明钠的金属性比铝的__________(填“强”或“弱”);常温下,可用 (填化学式)制容器盛装浓硫酸或浓硝酸。
(2)将一小块金属钠在空气中加热,发生反应的化学方程式为
(3)在AlCl3溶液中逐滴加入NaOH溶液至过量,观察到的现象是
查看答案和解析>>
科目: 来源:09—10年海南中学高二下学期期末考试化学卷 题型:填空题
(10分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1) 沉淀池中发生的化学反应方程式是 。
(2) 写出上述流程中X物质的分子式 。
(3) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(5) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(6) CO2是制碱工业的重要原料,目前,常用的两种制碱方法中CO2的来源有何不同? 。
查看答案和解析>>
科目: 来源:2010年安丘中学高二暑期练习化学卷(二) 题型:填空题
有A、B、C、D四种电解质,它们均由多种元素组成(元素的原子序数均小于20),相同浓度溶液的pH值是A<B<C<D,且只有A的pH小于7,四种物质的焰色反应皆显黄色,A与B、C、D都能反应,但仅与B、C反应产生无色无味的气体。向A溶液中加入Ba(NO3)2溶液,能产生不溶于硝酸的白色沉淀。试推断A、B、C、D的化学式并写出B和D反应的离子方程式。
(1)A: B: C: D:
(2)B和D反应的离子方程式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com