
科目: 来源:2011-2012学年江苏省江阴市一中高二上学期期中考试化学(必修)试卷 题型:实验题
(10分)味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”。某学校化学科研小组现对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定。
Ⅱ.设计实验方案:
(1)实验试剂:水、试剂X的溶液等
(2)实验过程: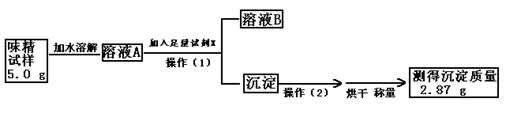 [
[
根据上述实验步骤回答下列有关问题:
①试剂X是 ,其作用是 。
②操作(1)所需要的玻璃仪器有 。
③操作(2)的名称 是 。
是 。
④通过计算判断该味精中NaCl的质量分数,是否符合其包装上标注的标准 。
⑤如果溶液A为50 mL,则溶液A中NaCl的物质的量浓度是多少?
查看答案和解析>>
科目: 来源:2011-2012年广西省桂林中学高一上学期段考化学试卷 题型:实验题
(18分)过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装 置:
置: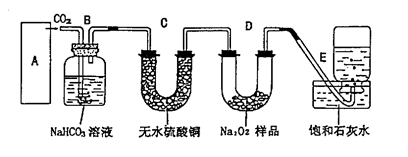
(1)请写出过氧化钠与二氧化碳反应的化学方程式,并标明电子转移的方向和数目: ;
(2)A中制取CO2的装置, 应从下列图①、②、③中选
应从下列图①、②、③中选 哪个图: ;
哪个图: ;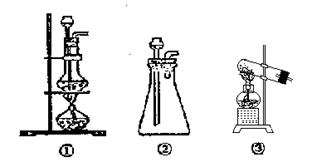
(3)B装置的作用是  ;
;
(4)为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 ;
(5)若E中石灰水出现轻微白色浑浊,请说明原因: ;
(6)当D中的1 .95g过氧化钠样品接近反应完毕时,你预测E装置内有
.95g过氧化钠样品接近反应完毕时,你预测E装置内有 何现象?
何现象?
;
(7)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集 到的氧气体积比理论计算值 (大或小),相差约 mL(取整数值,所用数据均在标准状况下测定),这是由于
到的氧气体积比理论计算值 (大或小),相差约 mL(取整数值,所用数据均在标准状况下测定),这是由于  ;
;
查看答案和解析>>
科目: 来源:2011-2012学年云南省玉溪一中高一上学期期中考试化学试题试卷 题型:实验题
(14分)为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
; _______________________________
(2)在(1)中应使用除杂试剂的化学式__________,在(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤 ②和④可否颠倒_
②和④可否颠倒_ ___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
___________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
步骤③和④可否颠倒___________。
(4)若先用盐酸再进行 操作⑤,将对实验
操作⑤,将对实验 结果产生影响,其原因是:
结果产生影响,其原因是:
(5)判断BaCl2已过量的方法是
查看答案和解析>>
科目: 来源:2011-2012学年广东省梅州市曾宪梓中学高一上学期中段考试化学试卷 题型:实验题
(10分)小明通过学习知道:Na2CO3、NaHCO3均能与盐酸反应,Na2CO3溶液还会与石灰水反应。
[产生疑问]NaHCO3溶液也能与石灰水反应吗?如果能反应,生成物可能是什么?
[进行试验]小明将NaHCO3溶液与石灰水混合,结果产生白色沉淀,已知Ca(HCO3)2能溶于水,碳酸氢盐在碱溶液中会生成碳酸盐。此白色沉淀是 ;为了进一步了解生成的含钠化合物有什么,继续探究:
[作出猜想]①只有NaOH ②有Na2CO3和NaOH ③
[实验设计】步骤1:取少量上述实验后的上层清夜于试管中,再滴加足量的CaCl2溶液(中 性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有 ;
性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有 ;
步 骤2:将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为 ,整个实验过程中无气泡产生,由此可知猜想②成立。
骤2:将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为 ,整个实验过程中无气泡产生,由此可知猜想②成立。
[拓展提高]若步骤1中未出现白色沉淀,则此时NaHCO3溶液与Ca(OH)2溶液反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2012届甘肃省兰州一中高三上学期期中考试理科综合试题(化学部分) 题型:实验题
(18分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调
节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
②步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
、 、 NaOH。
③步骤2中,判断加入BaCl2已过量的方法是
________________________。
(2)为检验精盐纯度,需配制100 mL 0.5mol/L(精盐)溶液,右图是该
同学转移溶液的示意图,图中的错误是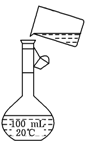
________________________________________________。
若在定容时仰视,则所配溶液的浓度_______0.5mol/L(填>或<)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则相同条件下收集的Cl2 (填>、=或<)
2L,原因
(4)某学习小组设计了如下图实验,将氯气依次通过下列装
置以验证氯气的性质: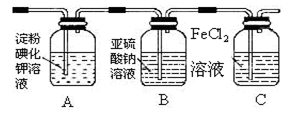

①通入氯气后,A中的现象是 ,整套实验装置存在的明显缺
陷是 。
②C装置中发生反应的离子方程式为 。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
查看答案和解析>>
科目: 来源:2012届江苏省扬州中学高三上学期练习化学试卷 题型:实验题
(14分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: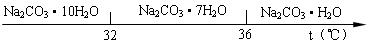
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
 M
M g2+):c(Fe3+)= ▲ 。
g2+):c(Fe3+)= ▲ 。 )“趁热过滤”时的温度应控制在
)“趁热过滤”时的温度应控制在  ▲ 。
▲ 。 2.36kJ·mol-1
2.36kJ·mol-1 (s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1查看答案和解析>>
科目: 来源:2012届福建省福州市罗源一中高三上学期第一次月考化学试卷 题型:实验题
(10分)我国化学家侯德榜(下图所示)改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)请写出碳酸钠的一种用途 。
(2)写出上述流程中X物质的分子式 。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是 。
(4)该流程中氨气和二氧化碳的添加顺序是:先通氨气后通二氧化碳,请说明理由: 。
查看答案和解析>>
科目: 来源:2012届甘肃省天水一中高三上学期第一阶段考试化学试卷 题型:实验题
(10分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00mL甲溶液,缓慢滴入乙溶液15.00mL,共收集到224mL(标准状况)气体
②量取15.00mL乙溶液,缓慢滴入甲溶液25.00mL,共收集到112mL(标准状况)气体。
(1)判断:甲是 溶液,乙是  溶液。
溶液。
(2)写出中所发①生反应的离子方程式 。
(3)乙溶液的物质的量浓度是多少?
查看答案和解析>>
科目: 来源:2012届江苏省致远中学高三第一次教学质量检测化学试卷 题型:实验题
(14分)工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A B 。
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是 。碳酸化时没有析出碳酸钠晶体,其原因是 。
(3)碳酸化后过滤,滤液D最主要的成分是 (填写化学式)。
(4)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为: ,滤液D加石灰水前先要加热,原因是  。
。
(5)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,需要测定的数据是加热前样品的质量(m1)与加热后残留固体的质量(m2),则纯碱中碳酸氢钠的质量分数为 。
查看答案和解析>>
科目: 来源:2012届江西省高安中学高三上学期第二次综合考试化学试卷 题型:实验题
(12分)、过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
已知:过碳酸钠与硫酸溶液反应的化学方程式如下: Na2CO4 +H2SO4 →Na2SO4 +H2O2 + CO2↑  2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。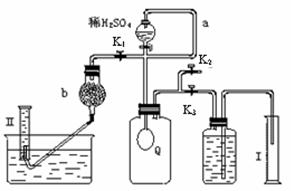
⑴Q内发生反应生成的气体为__________,导管a作用是 。
⑵为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭K1、K2,打开K3。当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________ _____,b中装的碱石灰的作用是_ _________________。
_________________。
⑶实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是____________
⑷某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是_______
| A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ |
B.量筒Ⅱ读数时 ,量筒液面高于水槽液面 ,量筒液面高于水槽液面 |
| C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x |
| D.气体体积数值x、y没有扣除滴加的硫酸的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com