
科目: 来源:2010年浙江省浙东北三校高二第二学期期中联考化学试题 题型:实验题
(共6分,每空2分)铜是日常生活中常见的金属。已知铜的原子序数为29。回答问题: (1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式 。
(1)铜是不活泼的金属,不会和稀硫酸反应,但在盛有铜和稀硫酸的试管中加入双氧水以后,能够看到铜溶解。请写出该反应的离子方程式 。 (2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
(2)如果不加氧化剂实现铜在稀硫酸溶液中的溶解,请设计一个实验装置完成此过程。在方框中画出该装置。
| |
 (3)写出你所设计装置中的化学反应的方程式 。
(3)写出你所设计装置中的化学反应的方程式 。查看答案和解析>>
科目: 来源:湖北省黄冈市2009—2010学年度高三年级期末考试理科综合能力测试化学试题 题型:实验题
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: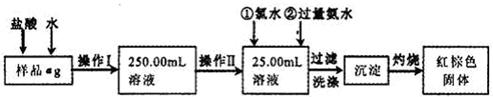
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填自选仪器名称),操作II必须用到的仪器是____________(填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
查看答案和解析>>
科目: 来源:鲁必修1综合卷 题型:实验题
(12分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3―→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平,不考虑2NO2??N2O4)。
(1)硝酸在该反应中体现的性质是________。
(2)0.004 mol Cu被硝酸完全溶解后,Cu失去的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________;所得溶液(假设溶质不扩散)的物质的量浓度是________。
(3)如果参加反应的Cu和HNO3的物质的量之比是3∶10,写出并配平该反应的离子方程式______________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________________________。
查看答案和解析>>
科目: 来源:2013届新课标高三配套月考(四)化学试卷(B卷)(带解析) 题型:实验题
[2012·山东卷] (11分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)如下图所示,过滤操作中的一处错误是____________________________。
(3)判断流程中沉淀是否洗净所用的试剂是________。高温焙烧时,用于盛放固体的仪器名称是________。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。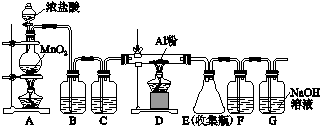
装置B中盛放饱和NaCl溶液,该装置的主要作用是________。F中试剂的作用是_____________________________。
用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________。
查看答案和解析>>
科目: 来源:2011-2012学年南京学大教育专修学校高一暑期结业测试化学试卷(带解析) 题型:实验题
第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金。某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金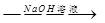 测定生成气体的体积
测定生成气体的体积
方案二:铝镁合金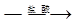 测定生成气体的体积
测定生成气体的体积
方案三:铝镁合金 溶液
溶液
 称量灼烧产物的质量。
称量灼烧产物的质量。
(1)实验小组根据方案二设计了两个实验装置,如下圈(图中的铁架台已省略)。
你认为选择 (选填甲或乙)装置进行实验更合理,误差更小。
(2)用方案三进行实验时,除了称量灼烧产物质量外,还需称量的是 。
(3)拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量 溶液时,生成沉淀的质量与加入
溶液时,生成沉淀的质量与加入 溶液体积的关系可用数轴关系表示:
溶液体积的关系可用数轴关系表示:
请你判断,根据上图数轴申的数据能否求出合金中镁的质量分数? (选填“能”或“不能”)
下列①②两题选一题作答。
①若不能求出合金中镁的质量分数,请说明理由 。
②若能求出合金中镁的质量分数,则镁的质量分数为 。
查看答案和解析>>
科目: 来源:2010-2011学年福建省三明一中高一下学期学段考试化学试卷(带解析) 题型:实验题
(10分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
查看答案和解析>>
科目: 来源:2011-2012年福建漳州芗城中学高二下学期期中考试文科化学试卷(带解析) 题型:实验题
(6分)某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。回答下列问题:
(1)操作①的名称 ;
(2)沉淀A的化学式是___________,滤液B中的阴离子除了Cl—、OH—外还有______________;
(3)步骤④的化学方程式为______________________________________;
(4)在操作②中要用到的玻璃仪器除了烧杯、玻璃棒,还有_________________。
查看答案和解析>>
科目: 来源:2011-2012学年云南省玉溪一中高二上学期期末考试化学试卷 题型:实验题
(共9分)已知NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,某混合物A含有
KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: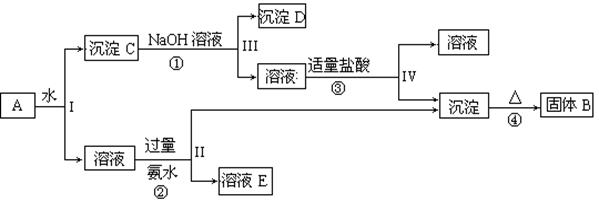 据此回答下列问题:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B ;沉淀D ;
(3)写出①、②、④四个反应的化学方程式,是离子反应的写出离子方程式
① ;
② ;
④  。
。
查看答案和解析>>
科目: 来源:2011-2012学年福建省师大附中高一上学期期末考试化学试卷 题型:实验题
(15 分)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)
(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择 (填“NaOH溶液”“盐酸”“FeCl3溶液”);步骤②的操作是 ,得到固体Ⅱ反应的离子方程式为
(2)固体Ⅲ的化学式为 步骤④反应的化学方程式为
(3)该铝合金中铝的质量分数是________________
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果 (填“偏高”“偏低”“不影响”)
查看答案和解析>>
科目: 来源:2011-2012学年广东省揭阳第一中学高一第二次阶段考试化学试卷 题型:实验题
(1)向KAl(SO4)2溶液中滴加过量氨水,现象是____________________________,反应的离子方程式______________________________________________,再向其中加入过量NaOH溶液,反应现象是____________________________________________,反应的离子方程式为_______________________________________________。
(2)下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把下表中各反应的相应图象的序号填入表中。
| 溶液 | 加入的物质 | 答案序号 |
| ①饱和石灰水 | 通过量CO2 | |
| ②AlCl3溶液 | 通过量NH3 | |
③MgCl2、AlCl3混合溶 液 液 | 逐滴加NaOH溶液至过量 | |
| ④AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
| ⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com