
科目: 来源:2011-2012学年福建省晋江市季延中学高一上学期期中考试化学试卷 题型:填空题
(7分)漂白粉是常用的消毒剂。漂白粉的有效成分是(填化学式) 。
(1)实验室制取氯气的反应方程式
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,该反应的化学反应方程式为:
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,该反应的化学反应方程式为 。
查看答案和解析>>
科目: 来源:2011-2012学年山东省日照一中高一上学期期中考试化学试卷 题型:填空题
(12分)饮用水消毒的主要目的是杀灭可引起霍乱、伤寒、痢疾等疾病的病菌,含氯消毒剂由于杀菌力 强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
强,价格低等优点,一直是当今世界上应用最广泛的一种杀菌剂,为人类的健康立下了汗马功劳。回答下面各小题。
(1)氯气是一种 色、具有刺激性气味、 (填“无”或“有”)毒的气体。
(2)在水灾后,卫生防 疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是 。
疫部门向广大居民发放了漂粉精,用于饮用水的杀菌消毒,漂粉精的有效成分是 。
(3)用化学方程式表示工业生产漂粉精的反应原理 。
(4)已知H2CO3的酸性比HClO强,若把漂粉精暴露在空气中,请你推测会发生什么反应,写出反应的化学方程式 ,根据这一特性,漂粉精的保存方法为 。
查看答案和解析>>
科目: 来源:2012届天津市滨海新区大港一中高三上学期第二次月考化学试卷 题型:填空题
(6分)(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。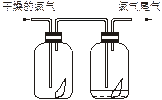
 (2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
(2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
工业上常用廉价的石灰乳吸 收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(均填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液 的毛巾捂住鼻子,最适宜采用的该物质是____ ___。
的毛巾捂住鼻子,最适宜采用的该物质是____ ___。
A.NaOH B.NaCl C.KBr D.Na2CO3
(4)氯气和二氧化硫都有毒,但将两者等物质的量混合通入水中毒性会消失,用离子方程式表示毒性消失的原因
查看答案和解析>>
科目: 来源:2012届江西省南昌外国语学校高三上学期期中考试化学(理)试卷 题型:填空题
(8分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl2更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑ +2H2O
+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。
饮用水中的ClO2、ClO2-含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2-也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
①请写出pH≤2 .0时ClO2--与I-反应的离子方程式 。
②请完成相应的实验 步骤:
步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2-的浓度为  mol·L-1(用含字母的代数式表示)。
mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省嘉兴市八校高一上学期期中联考化学试卷 题型:填空题
(6分)按要求写出下列方程式:
氯气通入氢氧化钠溶液
氯化铵和氢氧化钠共热
Al2(SO4 ) 3的电离方程式
查看答案和解析>>
科目: 来源:2012届山西省太原市高三第一学段测评考试化学试卷 题型:填空题
(10分)某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。已知:氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:
3C12+ 6OH— 5C1—+ ClO3+3H2O。该兴趣小组设计了下列实验装置,进行实验。
5C1—+ ClO3+3H2O。该兴趣小组设计了下列实验装置,进行实验。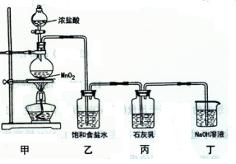
请回答下列问题:
(1)甲装置中发生反应 的化学方程式是 , 乙装置的作用是 。
的化学方程式是 , 乙装置的作用是 。
(2)小组成员发现,产物中Ca( ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO—、ClO3—两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为右图(不考虑氯气和水的反应)。
①图中曲线I表示 离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为 mol。
(3)为了提高Ca( ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:
。
查看答案和解析>>
科目: 来源:2012届安徽省黄山市高三七校联考化学试卷 题型:填空题
(15分)水是生命之源。饮用水消毒剂作为控制水质的一个重要环节,令世人关注。
⑴液氯消毒是最早的饮用水消毒方法。氯气溶于水能杀菌消毒的原因是:
。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。
臭氧(O3)是优良的水消毒剂。但当水中含溴离子(Br-)时,臭氧可氧化溴离子(Br-)为溴酸盐 (BrO- 3)。而溴酸盐 (BrO- 3)是对人体有致癌作用的化合物,我国规定饮用水中BrO- 3含量在10μg / L以下。测定BrO- 3浓度可用离子色谱法。
⑵水中的氯离子(Cl-)对BrO-3测定干扰很大,需要先除去氯离子(Cl-)。用右图的装置可除去水中的氯离子(Cl-)。
装置中Ag是 极(填电极名称),
Ag电极的电极反应式是 。
⑶ O3氧化溴离子的原理如下: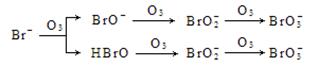
已知HBrO是一种弱酸,O3与HBrO反应很慢,BrO- 3主要是由BrO-与O3反应生成。
对影响生成BrO- 3速率的因素提出如下假设:(请你完成假设②和假设③)
假设①:反应的温度。
假设②:
假设③:
⑷设计实验验 证假设①。
证假设①。
验证实验操作:
a.配制250 mL 50 mg / L KBr溶液,加入 15 mL 某种pH=7的缓冲溶液(维持溶液的pH基本不变),并将溶液分为2份。
b.
实验中要测定的量是
实验结论是 
查看答案和解析>>
科目: 来源:2012届海南省琼海市嘉积中学高三上学期教学质量监测(一)化学试卷 题型:填空题
(6分)实验室里通常用 MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) △ MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol 。
mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol 。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到的混合液中ClO- 与ClO3- 物质的量之比为1∶1 ,反应的化学方程式是 。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市萧山八中高一上学期期中联考化学试卷 题型:填空题
(10分)某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置: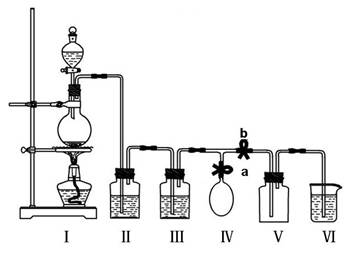
(1)写出装置Ⅰ烧瓶中发生反应的化学方程式: ,写出氯原子结构示意图 ;
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是 ;
装置Ⅲ的作用是干燥氯气,应盛放 。
(3)实验开始后,先 a b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外逸,再 a b,换好集气瓶后,继续收集氯气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的 (填字母)
A.氢氧化钠溶液 B.浓硫酸 C.水
查看答案和解析>>
科目: 来源:2011-2012学年浙江省杭州市萧山八中高一上学期期中联考化学试卷 题型:填空题
(10分)写出下列反应化学方程式
1、重氢形成的盐酸和碳酸钙反应
2、漂白粉露置在空气中变质
3、电解饱和食盐水 
4、次氯酸的不稳定性
5、适量的氯气与碘化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com