
科目: 来源:2010年银川二中高考预测(综合题)化学卷 题型:填空题
氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)="2NO(g) " △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g)  2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 ? 。实验室还可在 ? (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
②常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)
①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol
该反应在低温下不能自发进行的原因是 。
| A.△H >0 | B.温度较低时,△H影响为主 |
| C.△S<0 | D.温度较低时,△S影响为主 |
查看答案和解析>>
科目: 来源:2009-2010学年度泉州七中下学期高一期中考试化学卷 题型:填空题
(8分)氮元素在生命活动中扮演着十分重要的角色,回答下列与氮及其化合物有关的问题。
Ⅰ.为了提高农作物的产量,德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理 ;
Ⅱ.氨气通入水中可制得氨水,氨水能使无色的酚酞变红。请用电离方程式表示其原因: ; K^S*5U.C#O%
K^S*5U.C#O%
Ⅲ.氨气可以跟多种物质发生反应,请将上图实验中主要反应的化学方程式填在横线上: ; 。
查看答案和解析>>
科目: 来源:2010年湖南省普通高中学业水平考试化学卷 题型:填空题
(4分)在氮的单质和化合物中,遇到HCl会产生白烟的是 ;与氢氧化钙加热发生反应产生刺激性气味气体的是 。(用字母填空)
| A.氮气 | B.氨气 | C.硝酸钠 | D.氯化铵 |
查看答案和解析>>
科目: 来源:2010年长沙市一中学业水平模拟测试卷(三)化学卷 题型:填空题
实验室有如图所示的实验装置: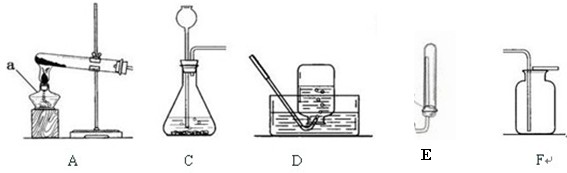
已知氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。在实验室中通常用加热固体氯化铵和氢氧化钙的混合物来制取氨气。试回答下列问题:
①实验室制取氨气可以选用_____________装置,收集氨气可以选用_______装置。
②试写出实验室制取氨气的化学反应方程式:
③如何检验收集的气体是氨气?试写出方法和结论:
查看答案和解析>>
科目: 来源:2010长沙市一中学业水平考试高三第二次模拟化学试题 题型:填空题
(6分) 在氮的单质和常见化合物中:
(1)常用作保护气(如填充灯泡、焊接保护等)的物质是 ;
(2)能与酸反应生成盐,在常温下为气态的物质是 ;
(3)在通常状况下是晶体,易溶于水,可以作氮肥,遇碱会放出带刺激性气味气体。写出它们与NaOH等强碱溶液反应的离子方程式 。
查看答案和解析>>
科目: 来源:2010年重庆市西南师大附中高一下学期期中考试化学试题 题型:填空题
(8分) 化合物A俗称石灰氮,以前是一种常用的肥料,其含氮量为35.0%,含钙量为50%。它可以用CaCO3通过下列步骤制得:
请回答下列问题:
(1)写出化学式:A________________、B________________;
(2)CaC2是__________________(填“离子”或“共价”)化合物;
(3)A与水完全反应的现象是产生白色沉淀并放出有刺激性气味的气体,写出A与水完全反应的化学方程式_______________________________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年安徽省泗县二中高二下学期期末考试化学试卷(带解析) 题型:填空题
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在
铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。反应一段时间后,停止加热。回答下列问题: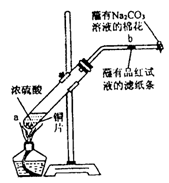
(1)写出a处反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)待试管中的液体冷却后,将试管上层液体倒去,再将剩余物质慢慢加入水中,可观察溶液呈 色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是 ,反应
的化学方程式为 。
(5)若用浓度为18 mol/L的浓硫酸100 mL与过量的铜片,加热使之反应,则被还原的硫酸(选填“大于”、“等于”或“小于”) 0.9 mol 。
查看答案和解析>>
科目: 来源:2010年湖南省浏阳一中高二下学期4月段考化学(理)试题 题型:填空题
把木炭加热至红热,投入到浓硝酸溶液中,产生NO2、CO2两种气体组成的红棕色混合气体X,用X作如下图所示的实验:
请回答下列问题:
(1)无色强酸溶液C是 ,单质F是 (填名称)。
(2)0.5mol碳与足量浓硝酸反应转移电子的物质的量为 mol;
(3)无色气体E遇到空气时,可以观察到的现象是 。
(4)产生白色沉淀A的化学方程式 。
查看答案和解析>>
科目: 来源:2010年浙江省慈溪中学高一第二学期期中考试(1~4班)化学试题 题型:填空题
(8分)磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧至反应物耗尽,共放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2充分反应的热化学方程式 。
(3)计算1mol P与O2反应生成固态P2O3的反应热ΔH= 。
查看答案和解析>>
科目: 来源:杭高2010届高三第二次月考化学试卷 题型:填空题
(7分)磷单质及其化合物的、有广泛应用。
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ; H
H
上述反应中,副产物矿渣可用来
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
Ni2+ + H2PO2-+ → Ni++ H2PO3-+
请配平该离子方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com