
科目: 来源:2012届江西省新余一中高三上学期第三次模拟考试化学试卷 题型:填空题
(10分)下图所示反应I、反应II和反应III均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同。
(1)C与J的水溶液反应后生成的含氧酸的电子式是 。
(2)E与G反应的离子方程式是
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是 。
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果。
①用Na2S2O3标准溶液滴定I2时选用的指示剂是 。
②生成I2的反应的离子方程式是 。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市直六校协作体高一第一学期期中考试化学试卷 题型:填空题
(6分)单晶硅是制作电子 集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体
集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体 管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为: ①SiO2 + 2C
管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为: ①SiO2 + 2C  Si + 2CO ②Si + 2Cl2
Si + 2CO ②Si + 2Cl2 SiCl4
SiCl4
③SiCl4 + 2H2 Si + 4HCl。回答下列问题:
Si + 4HCl。回答下列问题:
(1)上述反应中,属于氧化还原反应的是 (填序号)。
(2)反应①和③属于 。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(3)下列描述正确的是 。
A.氧化还原反应都是置换反应
B.判断一个反应是否为氧化还原反应的依据是是否有化合价的升降
C.化合反应全部都是氧化还原反应 D.复分解反应全部都是氧化还原反应
查看答案和解析>>
科目: 来源:2012届河南省郑州市智林学校高三上学期10月份月考化学试卷 题型:填空题
(10分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g~0.5g。已知NaNO2能发生如下反应:2NO + xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题:
+ xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题:
(1)上述反应中,x的数值是 ,y的数值是 。
(2)根据上述反应,可用化学试纸的生活中常见物质进行实验来鉴别工业盐和食盐,现
有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为 。
(3)某工厂废切削液中 含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列
含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列
物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
查看答案和解析>>
科目: 来源:2012届河南省南阳一中高三上学期第二次月考化学试卷 题型:填空题
(14分)二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等领域也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳。
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用双线桥法表示该反应的电子转移总 数
数
Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图所示
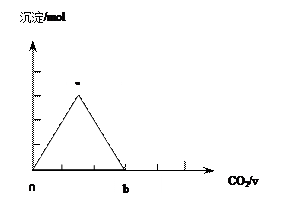
写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系; 并写出与上图中不同曲线处对应的离子反应方程式 ;
并写出与上图中不同曲线处对应的离子反应方程式 ;
。
查看答案和解析>>
科目: 来源:2012届四川省绵阳南山中学高三九月诊断考试理综试卷(化学部分) 题型:填空题
(共18分) W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。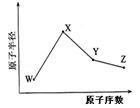
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素。
(1)X位于元素周期表的位置 ,X与硫元素形成的化合物的电子式为
(2) Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。理由为 。
(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
其分子属于 (填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是 。
(4)在25ºC、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程是 。
查看答案和解析>>
科目: 来源:2012届广东省江门一中高三9月月考化学试题 题型:填空题
(18分)二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用单线桥法表示该反应的电子转移总数
Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
①少量CO2通入过量的KOH溶液中,请写出离子反应方程式
②取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图所示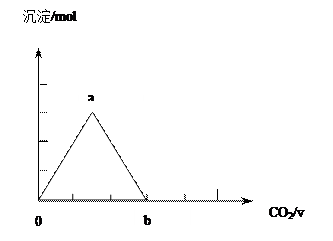

写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系;并写出与图②中不同曲线处对应的离子反应方程式
查看答案和解析>>
科目: 来源:2010-2011学年福建省福州八中高一下学期期中考试化学试卷 题型:填空题
(4分)制造光导纤维的原料名称是 ,水泥、玻璃、陶瓷属于 工业,日本福岛 核电站释放的137Cs和134Cs彼此互称为 ,白磷和红磷互称为 。
核电站释放的137Cs和134Cs彼此互称为 ,白磷和红磷互称为 。
查看答案和解析>>
科目: 来源:2010-2011学年福建省厦门六中高二下学期期中考试化学试卷 题型:填空题
(9分)硅是一种重要的非金属 单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)基态硅原子的核外电子排布式为 。
(2)晶体硅的微观结构与金刚石相似,晶体硅中Si-Si键之间的夹角大小约为______。
(3)下面关于SiO2晶体网状结构的叙述正确的是
A..最小的环上,有3个Si原子和3个O原子
B.最小的环上,有6个Si原子和6个O原子
C.存在四面体结构单元,O处于中心,Si处于4个顶角
(4)下表列有三种含硅物质(晶体)的熔点:
| 物质 | SiO2 | SiCl4 | SiF4 |
| 熔点/℃ | 1610 | -69 | -90 |
 航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由一种由硅及其同主族相邻短周期元素形成的化合物和碳纤维等复合而成的,它是一种新型无机非金属材料。该化合物的化学式为:________。已知该化合物的硬度仅次于金刚石,熔点比SiO2高,该化合物晶体属于________晶体[填“分子”、“原子”或“离子”。
航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由一种由硅及其同主族相邻短周期元素形成的化合物和碳纤维等复合而成的,它是一种新型无机非金属材料。该化合物的化学式为:________。已知该化合物的硬度仅次于金刚石,熔点比SiO2高,该化合物晶体属于________晶体[填“分子”、“原子”或“离子”。查看答案和解析>>
科目: 来源:2011届北京市朝阳区高三第一次综合练习(理综)化学部分 题型:填空题
(16 分)
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1) ①把含有较高浓度CO2的空气通入饱和K2CO3溶液。
②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________________________。
(2) 如将C O2与札以1:3的体积比混合。
O2与札以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是________(填序号)。
A.烷烃 B.烯烃 C.炔烃D,苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充人2 mol CO2和6 mol H2,一定条件下发生反应: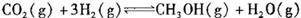 .
. O
O
测得CO2(g)和CH3OH(S)的浓度随时间变化如图所示。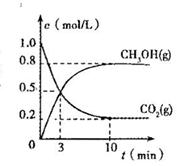
从反应开始到平衡,V(H2) =________氢气的转化率=________;能使平衡体系中4CH3OH)/n(CO2)增大的措施有________。
(3) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知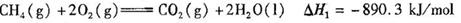

写出C02(g)与H2( g)反应生成CH4(g)与液态水的热化学方程式________________。
g)反应生成CH4(g)与液态水的热化学方程式________________。
(4) 某同学用沉淀法测定含有较髙浓度CO2的空气中CO2的含量,经査得一些物质在200C的数据如下表。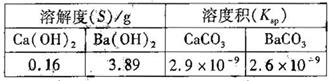
(说明: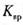 越小,表示该物质在水中越易沉淀)
越小,表示该物质在水中越易沉淀)
吸收CO2最合适的试剂是________[填"Ca(OH)3"或“Ba(OH)2"]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定________。
查看答案和解析>>
科目: 来源:2010—2011学年江西省抚州市教研室高一上学期期末考试化学试卷 题型:填空题
(6分)某石灰石样品中含有少量SiO2杂质。5.0g样品与50mL 2mol/L盐酸充分反应后,得到1064mL CO2(标准状况)。计算:
(1)石灰石样品中SiO2的质量分数为
(2)中和多余盐酸所需要1mol/L NaOH溶液的体积为  mL。
mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com