
科目: 来源: 题型:单选题
 下列叙述正确的是
下列叙述正确的是查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

 2FeO+2SO2
2FeO+2SO2 2Cu2O+2SO2,再由Cu2O与Cu2S反应制得单质铜.请写出该反应的化学方程式______.制得的铜块呈泡状(又称为泡铜),其原因是______.
2Cu2O+2SO2,再由Cu2O与Cu2S反应制得单质铜.请写出该反应的化学方程式______.制得的铜块呈泡状(又称为泡铜),其原因是______.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
| 选项 | 实验操作 | 发生现象 | 解释或结论 |
| A | 向NaCl和KI的混合溶液中,逐滴加入AgNO3溶液 | 溶液中先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 用玻璃棒蘸取氯水点到蓝色石蕊试纸上 | 试纸先变红后褪色 | 氯水中含有H+和HClO |
| C | 将铜片与芯片用导线连接后,插入稀硫酸中 | 铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
| D | 向某溶液中加入过量盐酸 | 产生能使澄清石灰水变浑浊的无色气体 | 该溶液为Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
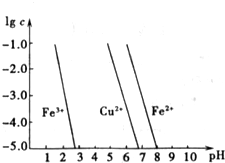 铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com