
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
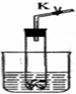 图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出).下列气体的制取宜使用该装置的是
图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出).下列气体的制取宜使用该装置的是查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
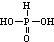 )中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2O
)中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2O查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
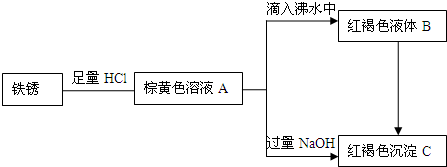
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 、SO
、SO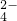 ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
 +,其物质的量之比n(Mg2+):n(Al3+):n(NH
+,其物质的量之比n(Mg2+):n(Al3+):n(NH +)=______.
+)=______. -的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.
-的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com