
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
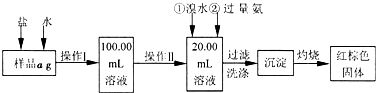
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 编号 | 实验步骤 | 实验现象 |
| ① | 用适量的蒸馏水溶解食盐,并将所得溶液分成2份 | |
| ② | 向第一份溶液中加入KSCN溶液,再加入氯水 | 溶液加入KSCN后无明显变化,加入氯水后变红 |
| ③ | 向第二份溶液中加入稀盐酸酸化,再加入足量KI固体,最后加入淀粉溶液 | 溶液变蓝 |
| 实验编号 | 1 | 2 | 3 |
| Na2S2O3溶液的体积/mL | 14.98 | 15.00 | 15.02 |
查看答案和解析>>
科目: 来源: 题型:单选题
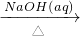 NaAlO2(aq)
NaAlO2(aq) Al(OH)3
Al(OH)3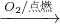 SO3
SO3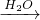 H2SO4
H2SO4 NaHCO3
NaHCO3 Na2CO3
Na2CO3 FeCl3(aq)
FeCl3(aq) 无水FeCl3
无水FeCl3 Mg(OH)2
Mg(OH)2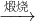 MgO.
MgO.查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:单选题
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去). 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com