
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
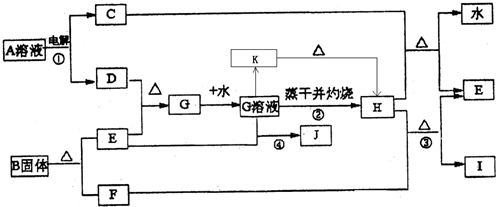
 到
到查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
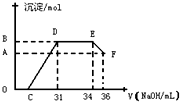 Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.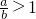 时,剩余固体是______,排出气体是______.
时,剩余固体是______,排出气体是______.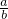 的值为______.
的值为______.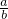 的值为______.
的值为______.查看答案和解析>>
科目: 来源: 题型:解答题
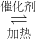 7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
7N2(g)+12H2O(g)也可处理NO2.则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是______L.| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
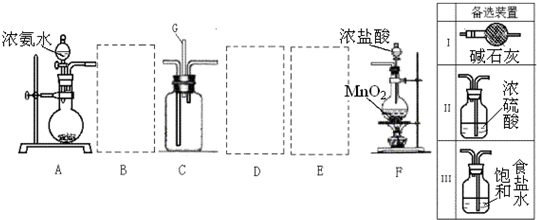
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com