
科目: 来源:2010—2011学年广东惠阳高级中学高一第二学期期末考试化学试卷 题型:填空题
(5分) 有W、X、Y、Z四种短周期元素,它们的核电荷数依次增大; W元素原子是所有原子中半径最小的; X元素原子L层电子数是K层电子数的3倍, Y元素原子的最外层电子数与电子层数相同;Z元素原子的最外层电子数比次外层少1。由此可知:
(1)写出它们的元素符号W_______X______Y_______Z________.
(2)X在元素周期表中的位置是 _________ 。
查看答案和解析>>
科目: 来源:2010—2011学年海南中学高一第二学期期末考试(2-20班)化学试卷 题型:填空题
(8分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X | Y | |
| | Z | W |
查看答案和解析>>
科目: 来源:2010—2011学年海南中学高一第二学期期末考试(1班)化学试卷 题型:填空题
(11分)甲元素的原子序数是9,乙是元素周期表第三周期中金属性最强的元素,丙元素原子核外有三个电子层,最外层电子层上有6个电子,丁元素比丙多一个质子,由此推断:
(1)甲元素在周期表中位于第二周期的_________族
(2)甲元素的气态氢化物的稳定性比HCl的_________(填“强”或“弱”)
(3)乙元素单质在空气中燃烧,生成一种淡黄色的固体的名称是_________ ,指出它所含的化学键的类型_______________________。
(4)乙元素原子半径比丙元素原子_________(填大或小)
(5)丙元素最高价氧化物的水化物的分子式是_________,它的酸性比磷酸的_________( 填“强”或“弱”)
(6)另有A,B,C三种短周期元素,A和B同周期,A和C同主族,三者的原子序数之和为41,三者的最外层电子总数为19,则推断出的元素依次为A________B________C________.(填元素符号)
查看答案和解析>>
科目: 来源:2010—2011学年辽宁大连23中高二下学期期末考试化学试卷 题型:填空题
(10分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的外围电子排布式为 ,该元素与元素X、Y能形成的[W(XY)4]2-离子中,含有的化学键是 。
a.离子键 b.极性键 c.非极性键 d.配位键
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取 杂化,1molM分子中σ键和π键的个数比为 。
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是 。
(6)WR的晶胞结构如图所示,阴离子周围最近的阳离子有 个 ;
;
WR晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出计算式)。
查看答案和解析>>
科目: 来源:2010—2011学年江苏省盐城中学高二第二学期期末考试化学试卷 题型:填空题
(18分)
(1)O22+与N2互为等电子体, O22+的电子式可表示为 ; O22+中 键数目和
键数目和 键数目之比为 。
键数目之比为 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成红棕色沉淀Cu2C2。Cu+基态核外电子排布式为 ; Cu+的配位数为 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是 。
。丙烯腈分子中碳原子轨道杂化类型是 。
(4)在合成氨反应中,催化剂铁表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比为 。
查看答案和解析>>
科目: 来源:2010—2011学年江苏省盐城中学高一第二学期期末考试化学试卷 题型:填空题
(16分)有原子序数依次增大的五种短周期元素A、B、C、D、E,已知 A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,回答下列问题:
(1)B在周期表中的位置是 ,E的原子结构示意图
(2)写出同时含A、B、C、D四种元素的两种盐的化学式 、
(3)BD2的结构式为 ,E和D形成的一种化合物与BD2发生氧化还原反应,该反应的方程式为
(4)C元素的最高价氧化物的水化物与其氢化物反应的离子方程式
(5)在一定条件下,一定量的A的单质与C的单质反应,可生成17克气体化合物CA3,同时放出46kJ的热量,写出该反应的热化学方程式
查看答案和解析>>
科目: 来源:2010—2011学年度河南大学附中高二下学期期末考试化学试卷 题型:填空题
(12分)H、C、N、O是几种重要的非金属元素。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是 。
(2)H3O+中H—O—H的键角比H2O中H—O—H的键角大,是因为 。
(3)与CO2是等电子体,可检验溶液中Fe3+的阴离子的电子式 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)==3N2(g)+4H2O(g) △H=-1038.7 kJ/mol
若该反应中有4mol N—H键断裂,则形成的π键有___________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a、离子键 b、共价键 c、配位键 d、范德华力
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是 (填标号)。
a、CF4 b、 CH4 c、 NH4+ d、H2O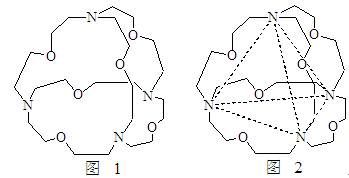
查看答案和解析>>
科目: 来源:2010—2011学年度河南大学附中高二下学期期末考试化学试卷 题型:填空题
(16分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为 。
(2)SO42ˉ的立体构型是 ,其中S原子的杂化轨道类型是 。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为 。一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ,该晶体中,原子之间的作用力是 。
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如下图),该晶体储氢后的化学式应为 ;假设在另一条件下,氢原子可进入到由Cu原子与Au原子构成的八面体空隙中心,该晶体储氢后的化学式为 。(提示:查找四面体、八面体时,需假设Cu原子与Au原子等同;每个四面体、八面体内只填充一个氢原子)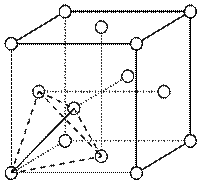
查看答案和解析>>
科目: 来源:2010—2011学年度本溪市第一中学高一下学期期末考试化学试卷 题型:填空题
(13分)短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素, D单质燃烧时呈现黄色火焰, D的单质在高温下与C的单质充分反应, 可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称: A B D
(2)E在周期表中的位置: ____________________
(3)F离子结构示意图: __________________
(4)A、B组成的最简单化合物的名称是___________
(5)用电子式表示BC2的形成过程:
(6)C单质与D单质在常温下反应的产物的电子式_______________________
(7)C单质与D单质在点燃条件下反应的产物W中所含化学键类型为__________ ____,将W溶于水的化学方程式_______________ ____________,W的用途有________ ___ (填一种)
(8)能说明E的非金属性比F的非金属性____(填“强”或“弱”)的事实是: ______________________ (举一例)。
查看答案和解析>>
科目: 来源:2010—2011学年海南省嘉积中学高一下学期教学质量检测化学检测(三)(理) 题型:填空题
(10分) X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。其中Z元素原子的核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素W位于周期表中第 周期, 族;
(2)这些元素的氢化物中,水溶液呈碱性的是 (写化学式),
实验室检验这种氢化物通常采用的方法是______________________,
现象是____ ;
(3)XW2的电子式为 ;
(4)Z的最高价氧化物对应的水化物的化学式为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com