
科目: 来源:2012届山东省莱州一中高三第三次质量检测化学试卷 题型:填空题
(16分)I、关于As的反应中,反应物与生成 物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是 。
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为 。
③根据上述反应可推知  。(填序号)
。(填序号)
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4> KBrO3 KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |

 物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
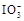 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在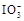 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。查看答案和解析>>
科目: 来源:2012届浙江省绍兴市第一中学高三回头考试化学试卷 题型:填空题
A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______ ______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________ _________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____ __(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__ _____
①R4与R3、R2互为同位素 ②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构 ④R4是一种新型化合物
查看答案和解析>>
科目: 来源:2012届福建省宁德市高三毕业班质量检查化学试卷 题型:填空题
(11分)
X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X、Q同主族,X元素的原子半径最小,Y元素原子的最外层电子数是内层电子数的2倍,Z元素的最高价氧化物的水化物甲与其气态氢化物化合生成一种盐乙;X、Y、Z、Q四种元素都能与W元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)Q的原子结构示意图为 。
(2)Y和W相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是____(选填字母序号)。
a.常温下,Y的单质呈固态,W的单质呈气态
b.W的气态氢化物的稳定性强于Y的气态氢化物
c.Y与W形成的化合物中,Y呈正价
d.W的最高价氧化物的水化物酸性强于Y的最高价氧化物的水化物
(3)X、Y、W、Q四种元素组成的某无机化合物,受热易分解。写出少量该化合物的溶液与足量的Ca(OH)2溶液反应的离子方程式: 。
(4)常温下,甲、乙的水溶液pH均为5。则甲、乙的水溶液中由水电离出的H+浓度大小关系为:甲____乙(填“>”、“<”或“=”)。
(5)利用原电池原理,将X、Z的单质气体分别通人电池的两极,用质子导电陶瓷传递H+,可合成ZX3,该电池的正极反应式为 。
查看答案和解析>>
科目: 来源:2012届福建省龙岩市高三教学质量检测化学试卷 题型:填空题
(12分)Q、W、X、Y、Z是原子序数逐渐增大的短周期元素。已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数 是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。(注:答题应根据题目要求,用元素符号或化学式来表示对应元素或物质)
是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。(注:答题应根据题目要求,用元素符号或化学式来表示对应元素或物质)
(1)Z的离子结构示意图
(2)为了提高工业合成XQ 3产率(该反应为放热反应),下列措施合理的是
3产率(该反应为放热反应),下列措施合理的是
a.升高温度
b.加 入催化剂
入催化剂
c.将XQ3分离出去
d.增大反应体系压强
(3)WQ4与Y2反应通过下图装置可将化学能转化为电能。b电极反应式为 
(4)标况下2.24LWY2被200mL 1 mol/LZYQ溶液吸收,所得溶液阴离子浓度从大到小的顺序是 
(5)下图为某反应体系各物质(均为气体)的量及能量关系,该反应的热化学方程式为 。
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,其化学方程式是 。
查看答案和解析>>
科目: 来源:2011-2012学年上海理工大学附属中学高二上学期选修摸底考试化学试卷 题型:填空题
(9分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目: 来源:2011-2012学年上海理工大学附属中学高一上学期期末考试化学试卷 题型:填空题
(6分)古希腊哲学家德谟克利特提出 论;到了19世纪初,英国物理学家和化学家 提出近代原子论,为近代化学发展奠定了基础;到了20世纪初,英国科学家 发现了电子,提出原子的 模型。随着X射线的发现与元素放射性的发现,英国物理学家 在1911年提出了原子的 模型,为原子结构的现代模型打下了基础。
查看答案和解析>>
科目: 来源:2012届河南省信阳市高中毕业班第二次调研考试化学试卷 题型:填空题
(11分)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2 2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是____________。
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是_____________。
(4)元素Cl与S元素相比,非金属性较强的是_____________(用元素符号表示),下列表述中能证明这一事实的是________________
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态
d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是___________________________________________。
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系______________________________。
查看答案和解析>>
科目: 来源:2012届黑龙江省哈尔滨市第六中学高三上学期期末考试化学试卷 题型:填空题
(10分)A、B、C三种短周期元素在周期表中相对位置如右图:
| A | | | |
| | | B | C |
查看答案和解析>>
科目: 来源:2012届江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(12分)本题有A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(1)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。试回答下列问题:
①Ti元素在元素周期表中的位置是 ;其基态原子的
电子排布式为 。
②偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 ;晶体内与每个“Ti”紧邻的氧原子数为 个。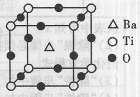
(2)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。已知氰分子中键与键之间的夹角为180。,并有对称性,其结构式为 ,与CN一互为等电子体的 单质的分子式为 。
单质的分子式为 。
B.某课题小组同学测量液态奶含氮量的实验过程如下:
步骤:
①在烧杯中加入10.00mL液 态奶和辅助试剂,加热
态奶和辅助试剂,加热
充分反应;
②将反应液转移到大试管中;
③按右图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出); 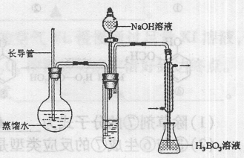
④取下锥形瓶,滴加指示剂,用0.1000mol·L-1盐酸
标准液滴定;
⑤重复测定数次,再用10.00mL蒸馏水代替液态奶进
行上述操作。
数据记录如下:
回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的离子方程式为 。
(2)步骤③的实验装置中需要加热的仪器是 (填仪器名称),长导管的作用是  。
。
(3)不做空白对照实验对实验结果有何影响 (填“无影响”,或“偏高”,或“偏低”)。
(4)计算10.00mL液态奶中的含氮量应代人计算的盐酸体积是 mL,该 液态奶的含氮量 mg·mL-1。
液态奶的含氮量 mg·mL-1。
查看答案和解析>>
科目: 来源:2012届山东省聊城市五校高三上学期期末联考化学试卷 题型:填空题
(10分)短周期中的A、B、C、D、E 5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2?离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1︰1的离子化合物。
(1)E元素的离子结构示意图为________。
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为______、_______。
(3)A、B、C、D、中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L?1的X溶液与0.1mol·L?1的Y溶液等体积混合后,溶液呈碱性。请判断:
①X的化学式为 ,Y的化学式为 ;
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com