
科目: 来源:2011—2012学年湖北省孝感高中高一下学期期中考试化学试卷(带解析) 题型:填空题
(14分)有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
请写出:
(1)A元素的最高价氧化物的电子式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目: 来源:2011-2012学年辽宁省开原高中高一下学期期中考试化学试卷(带解析) 题型:填空题
(11分)下图是元素周期表的框架图,请根据下面提问回答: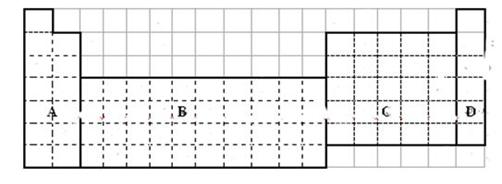
(1)在上表中画出金属和非金属的分界线。
(2)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
(3)在此表中所含元素最多的周期是 ,所含元素最多的族是
(4)用物质的名称填写,通常状况呈液态的非金属单质是 ,地壳中含量最多的非金属 元素是 。
(5)在原子序数为1~18号元素中,请用化学式填写。
与水反应最剧烈的金属元素是 ;元素的气态氢化物最稳定的物质是 ;元素的最高价氧化物所对应的酸其酸性最强的物质是 ;用电子式表示“原子半径最大的金属元素与质子数为16的元素形成的化合物”的形成过程:
查看答案和解析>>
科目: 来源:2011-2012年湖南湘潭等四县一中高一下学期期中联考化学试卷(带解析) 题型:填空题
(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目: 来源:2011-2012年湖南湘潭等四县一中高一下学期期中联考化学试卷(带解析) 题型:填空题
(10分)下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
(1)1 mol A与足量D的氢化物完全反应产生的气体在标准状况下的体积为________L。
(2)写出B的最高价氧化物的电子式________。
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化: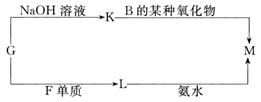
其中化合物M是一种白色胶状沉淀,则M为(填化学式)________________;
K的溶液与B的某种氧化物反应的化学方程式为____________________________;
一种新型无机非金属材料由G元素和C元素组成,其化学式为____________。
查看答案和解析>>
科目: 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(14分)硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有滑腻感,可做润滑剂。硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
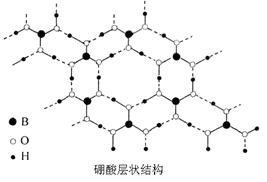
(1)B原子结构示意图为_______________________。
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
(3)下列有关硼酸晶体的说法正确的是_______________。
A、H3BO3分子的稳定性与氢键有关
B、平均1 mol H3BO3的晶体中有3 mol氢键
C、硼酸晶体中层与层之间作用力是范德华力
D、B为sp2杂化,同一层内主要作用力是共价键和氢键
(4)根据对角线规则,与B性质相似的元素是________。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是______。
A HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=______;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数):
____________________________________________________________。
查看答案和解析>>
科目: 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2。
(1)X的元素符号为_______,Z元素位于周期表第_______周期第________族。
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式)。
(3)Z的最高价氧化物的水化物的化学式为________________。
(4)12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的 键数目为 。
键数目为 。
(5)含W元素的最高化合价的含氧酸根离子是___________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:
______________________________________________________________________。
查看答案和解析>>
科目: 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
查看答案和解析>>
科目: 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(16分)下表为周期表的一部分,表中所列的字母分别代表一种化学元素。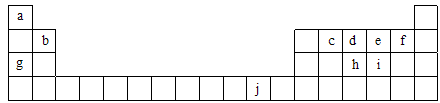
用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式___________________________。
(2)在c6a6分子中,元素c为 杂化,该分子是 分子(填“极性”或“非极性”)。
(3)ci2分子的电子式为_________________________,ci2与ce2比较,沸点较高的是_____________(写分子式)。
(4)第一电离能:h______i;电负性:g______b(填“>”、“<”或“=”)。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是 。
| A.j位于元素周期表中第四周期、ⅠB族,属于ds区元素 |
| B.d的基态原子中,2p能级为半充满,属于p区元素 |
| C.最外层电子排布式为4s1,一定属于ⅠA族 |
| D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族 |
查看答案和解析>>
科目: 来源:2011-2012年重庆西南大学附中高一下学期期中考试化学试卷(带解析) 题型:填空题
(12分)几种短周期元素的原子半径及某些化合价见下表:
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | –1 | –2 | +4、–4 | +4、–2 | +5、–3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
查看答案和解析>>
科目: 来源:2011-2012学年吉林长春市十一高高一下学期期中考试化学试卷(带解析) 题型:填空题
(12分)A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 。(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com