
科目: 来源:2012-2013学年吉林省汪清六中高二下学期期中考试化学试卷(带解析) 题型:填空题
已知N、P同属于元素周期表的第VA族元素,N在第2周期,P在第3周期。NH3
分子呈三角锥形,氮原子位于锥顶,三个氢原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的构型关系是________(填“相同”或“相似”或“不相似”),P—H______极
性(填“有”或“无”),PH3分子________极性(填“有”或“无”)。
(2)NH3与PH3相比,热稳定性________(填化学式)更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________.
| A.键的极性N—H比P—H强 | B.分子的极性NH3比PH3强 |
| C.相对分子质量PH3比NH3大 | D.NH3分子之间存在特殊的分子间作用力 |
查看答案和解析>>
科目: 来源:2012-2013学年重庆市綦江中学高一下学期期末模拟考试化学试卷(带解析) 题型:填空题
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物, E的阳离子与A的阴离子核外电子层结构相同。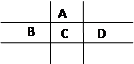
请回答下列问题:
⑴B元素在周期表中的位置为 。
⑵写出A与氢元素能形成原子物质的量之比为1∶1的化合物的电子式 ,分子中所含共价键的类型为 。
⑶比较A、C氢化物的的沸点:A C(填大于、小于或等于),
原因是 。
⑷B、C、D的原子半径由大到小的顺序为(用元素符号表示) 。
⑸若将E制作成电极与石墨用导线相连,回答下列问题:
①将两电极插入盛有稀H2SO4的烧杯中形成原电池,E电极为 极,写出该电池的总反应(用离子方程式表示) 。
②若将两电极插入盛有NaOH溶液的烧杯中,能否形成原电池?若能,请写出总反应的化学方程式 ;若不能,其理由是 。
查看答案和解析>>
科目: 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:填空题
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.075 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +5,—3 | +3 | +6,—2 | —1 | —2 |
 2AE2(g)已达到平衡状态的是 (填代号)
2AE2(g)已达到平衡状态的是 (填代号)查看答案和解析>>
科目: 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:填空题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ,该物质所含有的化学键的类型为 。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 。
查看答案和解析>>
科目: 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:填空题
下表是元素周期表的一部分,表中所列字母分别代表一种元素。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | A | | | | | | |
| 二 | | | | B | C | D | E |
| 三 | F | | G | H | | I | K |
| 四 | J | | | | | | L |
查看答案和解析>>
科目: 来源:2012-2013学年重庆市三峡名校联盟高一下学期期中考试化学试卷(带解析) 题型:填空题
(1)在CH4、H2S、NH4+、H2O、OH—、HCl、Na、Mg2+八种粒子中,选择符合下列要求的粒子填空:
①上述粒子中与K+质子数不同,电子数相同的有 ;
②上述粒子中与NH3质子数相同,电子数也相同的有 ;
③上述粒子中电子数大于质子数的有 。
(2)用锌片、铜片和稀硫酸组成的原电池,该电池的负极材料是 ,正极的电极反应式为 ,电池工作时电子流向 (填“正极”或“负极”)。
(3)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ;
②A的平均反应速率为 ;
③5min时B的转化率为 。
查看答案和解析>>
科目: 来源:2012-2013学年河南省偃师高级中学高二下学期第二次月考化学试(带解析) 题型:填空题
已知:
① A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素X、Y、Z的原子序数依次递增。
② X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 ??(用元素名称填空)。?
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
查看答案和解析>>
科目: 来源:2012-2013学年北京市房山区房山中学高二下学期期中考试化学试卷(带解析) 题型:填空题
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为 ;Al与NaOH溶液反应的离子方程式为
。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②平衡时容器内N2的浓度是 mol·L-1。
③SiCl4(g)的转化率是 。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
查看答案和解析>>
科目: 来源:2012-2013学年北京市房山区房山中学高一下学期期中考试化学试卷(带解析) 题型:填空题
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)用电子式表示X与W组成的化合物的形成过程 ;
(2)由X与Z组成的某化合物中存在非极性键,则该化合物的分子式为 ;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液不能与铜反应,浓溶液能与铜在加热条件下反应,该反应的化学方程式为: ;
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH浓溶液反应的离子方程式: ;
②又知A既能与盐酸反应,又能与氯水反应,写出与盐酸反应的离子方程式: ;
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1molB中含有6 mol结晶水。对化合物B进行如下实验:
取B的溶液加入足量的NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
另取B的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
由上述实验现象可知:B的化学式为 。
查看答案和解析>>
科目: 来源:2012-2013学年北京市房山区房山中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(1)研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu="2" FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
| 实验装置 | 实验现象 | 实验结论 |
| | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com