
科目: 来源:2012-2013学年湖北省荆州市监利县柘木中学高二下第二次月考化学卷(带解析) 题型:填空题
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是 ;N2H4分子中氮原子轨道的杂化类型是________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
查看答案和解析>>
科目: 来源:2012-2013学年湖北省荆州市监利县柘木中学高二下第二次月考化学卷(带解析) 题型:填空题
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子。
③Z元素的电离能(用符号I表示)数据见表(kJ·mol-1)
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
查看答案和解析>>
科目: 来源:2012-2013学年广东省实验中学高一下学期期末考试化学试卷(带解析) 题型:填空题
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1) 元素名称: B ______ ; D ______。
(2) C元素位于周期表中 周期 族。
(3) 写出A的最高价氧化物与过量的C的最高价氧化物的水化物反应的离子方程式:
__________________________________________________________________________。
(4) 用电子式表示化合物 C2D 的形成过程:
__________________________________________________________________________。
查看答案和解析>>
科目: 来源:2012-2013学年云南省滇池中学高一下学期期末考试化学试卷(带解析) 题型:填空题
| | 第1列 | | ||||||
| 1 | ① | 第2列 | 第13列 | 第14列 | 第15列 | 第16列 | 第17列 | 第18列 |
| 2 | | | | ② | ③ | ④ | | ⑧ |
| 3 | ⑤ | | | | ⑥ | ⑦ | ⑨ | |
查看答案和解析>>
科目: 来源:2012-2013学年河南省唐河县第一高级中学高一下第五次月考化学试卷(带解析) 题型:填空题
下列各组物质中,属于同位素的是___________,属于同素异形体的是___________,互为同系物的是___________,属于同分异构体的是___________,属于同种物质的是___________。
①O2和O3 ②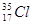 和
和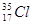 ③CH3CH2CH2CH3和CH3CH(CH3)2
③CH3CH2CH2CH3和CH3CH(CH3)2
④CH3CH2CH2CH(C2H5)CH3和CH3(CH2)2CH(CH3)CH2CH3 ⑤CH3(CH2)3CH3和CH3CH3
⑥ 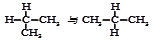
查看答案和解析>>
科目: 来源:2012-2013学年河南省安阳一中高一下学期第二次阶段测试化学试卷(带解析) 题型:填空题
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | | | | ⑥ | | ⑦ |  | |
| 三 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 四 | ② | ④ | | | | | ⑨ | |
 三种元素形成的气态氢化物最稳定的是 。
三种元素形成的气态氢化物最稳定的是 。查看答案和解析>>
科目: 来源:2012-2013学年河南灵宝市第三高级中学高一下第三次检测文科化学卷(带解析) 题型:填空题
已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号X Y Z W
(2)写出下列元素在周期表中的位置X Y
Z W
查看答案和解析>>
科目: 来源:2012-2013学年河南灵宝市第三高级中学高一下第三次检测文科化学卷(带解析) 题型:填空题
碱金属元素原子最外层的电子都是______个,在化学反应中它们容易失去______个电子;卤素原子最外层的电子都是______个,在化学反应中它们容易得到______个电子;
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷带解析) 题型:填空题
合金是建筑航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置是 。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为 。
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为 。焊接过程中使用的保护气为 (填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为 。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为 。
(3)航母螺旋浆主要用铜合金制造。
①80.0gCu-Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0,则合金中Cu的质量分数为 。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合如图信息推断该合金中除铜外一定含有 。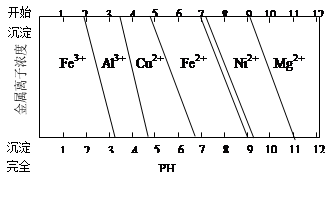
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅰ卷带解析) 题型:填空题
[化学—选修3:物质结构与性质](15分)
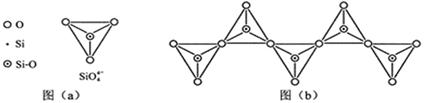
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/(kJ?mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com