
科目: 来源:2011-2012学年四川省雅安中学高一下学期3月月考化学试卷(带解析) 题型:实验题
(8分)某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。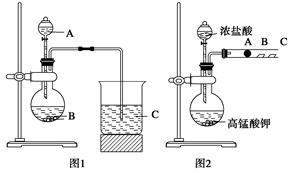
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
上述反应的离子方程式分别为_______________________________________________;
________________________________________________________________________。
(2)乙同学的实验原理是_____________________________________________ 。
写出B处的离子方程式: ___________________________________________________。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省濉溪县临涣中学高一下学期第一次月考化学试卷(解析版) 题型:实验题
(9分)在复习元素周期律过程中,某研究性学习小组的几位同学拟通过具体的实验来探讨某些金属元素的性质差异,下面是他们设计的探究性实验方案,请填写下列空白:
(1) 实验目的:比较钠、镁、铝金属性强弱。
(2) 实验用品:酒精灯、 、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、6 mol·L-1的盐酸
(3)实验过程与现象记录
I.甲同学的方案如下:
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a取已切去表皮的一小块金属钠,放入盛有水的某容器中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b向盛有适量水(内含2滴 酚酞的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c向两支盛有3mL6mol·L-1盐酸的试管中加入大小相同的镁片和铝片 | 镁、铝与盐酸反应产生气泡剧烈程度不同 | 镁与盐酸反应产生气泡速率较快 |
查看答案和解析>>
科目: 来源:2011-2012学年江西省上饶市横峰中学高一下学期第一次月考化学试卷 题型:实验题
(8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目: 来源:2012届江苏省南通市高三上学期期末调研测试化学试卷 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
⑴基态Fe3+的核外电子排布式为 。C、N、O三种元素的第一电离能由大到小的顺序是 。
⑵尿素分子中C、N原子的杂化方式分别是 。
⑶[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。与NO3—互为等电子体的一种化合物是 (写化学式)。
⑷CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
B.脱氢醋酸是一种难溶于水的低毒、高效广谱抗菌剂,可由乙酰乙酸乙酯经脱醇缩合而成,反应原理为:
实验步骤如下:
①在反应器中加入乙酰乙酸乙酯、少量催化剂和数粒沸石,在瓶口安装分馏装置。
②低温加热(不超过85℃)60~70min;然后大火加热蒸出乙醇。
③将反应液趁热倒入烧杯中,冷却到室温,有柠檬黄色晶体析出。
④将柠檬黄色晶体转移至圆底烧瓶B中,加水15mL,滴入1滴硫酸,进行水蒸气蒸馏(如图所示)。从水蒸气蒸馏液中经抽滤可分离出脱氢醋酸,再烘干即得成品。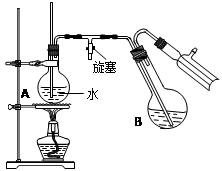
步骤①中加入沸石的目的是 。
步骤②中,在60~70min内低温加热的目的是 ,然后大火加热蒸出乙醇的目的是 。
步骤④中水蒸气蒸馏装置中烧瓶A的作用是 ,玻璃管的作用是 。
用测得相对分子质量的方法,可以检验所得产物是否纯净,测得相对分子质量通常采用的仪器是 。
查看答案和解析>>
科目: 来源:2012届山东省临清三中高三上学期学分认定测试化学试卷 题型:实验题
(7分)Ⅰ、下列说法不正确的是 。
| A.用100mL的容量瓶准确量取100mL液体 |
| B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 |
| C.用托盘天平称量NaCl时,NaCl放在纸上; 称量NaOH时,NaOH放在小烧杯里 |
| D.用加热的方法提取NH4C1固体中的少量碘单质 |
查看答案和解析>>
科目: 来源:2011-2012学年辽宁省庄河六中高二上学期开学初考试化学试卷 题型:实验题
(13分) 现有短周期元素X形成的单质A与NaOH溶液反应,
有如下 转化关系:
转化关系: ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为 ,实验室制备A的化学方程式为 ;
(2)若常温常压下,A为非金属固态单质 ,且其在电子工业中有着重要的用途,则工业制取A化学方程式为 ;
,且其在电子工业中有着重要的用途,则工业制取A化学方程式为 ;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
;其最高氧化物与NaOH溶液反应的离子方程式为 ;
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
①装置中导管a的作用是  ;
;
②实验中准确测得4个数据:实验前该合金的质量m1 g,实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL;则通常状况时气体摩尔体积Vm=____________L·moL-1。
查看答案和解析>>
科目: 来源:2010-2011年山东省威海市高一下学期期末模块考试 题型:实验题
(7分)为了验证镁和铝的金属性强弱,某同学欲设计实验验证。
提供的试剂有:镁带、铝条、水、盐酸、浓硫酸。
(1)所选试剂为_______________;
(2)发生反应的化学方程式为_______________;
(3)请简要叙述其操作过程及现象_______________。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省南京六中高二下学期期末考试化学试题 题型:实验题
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL的容量瓶中定容配成250 mL烧碱溶液 |
| B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读 数为V1 数为V1 |
 ______________________________________。
______________________________________。查看答案和解析>>
科目: 来源:2010—2011学年度安徽省马鞍山市高一第二学期期末测试化学试卷 题型:实验题
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
| 实验方案 | 实验现象 | ||||
| ①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞。 ②向新制的H2S饱和溶液中滴加新制的氯水 ③钠与滴有酚酞试液的冷水反应 ④镁带与2mol/L的盐酸反应 ⑤铝条与2mol/L的盐酸反应 |
|
| 实验方案 | 实验现象 | 有关离子方程式 |
| | A | |
| | B | 不填 |
| | C | 不填 |
| | D | 不填 |
| | E | |
查看答案和解析>>
科目: 来源:2010-2011学年江西省新建二中高二下学期期末考试化学试卷 题型:实验题
实验室通过简单的“试管实验”,即可探究元素金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
试剂:①镁条 ②铝条 ③AlCl3溶液 ④MgCl2溶液
⑤NaOH溶液 ⑥氯水 ⑦溴水 ⑧NaBr溶液
| 实验方案 (只填写选用试剂序号) | 实验现象 | 结论 | |
| ⑴ | | 一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 | 金属性: |
| ⑵ | | | 非金属性:Cl>Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com