
科目: 来源:2010年郑州市智林学校高二下学期期末考试化学试题 题型:填空题
(10分)m、n、x、y四种主族元素在周期表里的相对位置如下图所示。已知它们的原子序数总和为46,则: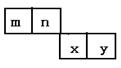
(1)元素n的气态氢化物的分子式为 ,空间构型为 。
(2)m与y所形成的化合物含 键,属 分子。(填“极性”或“非极性”)
(3)x位于周期表的第 周期,第 族;其原子结构示意图为 。
(4)由n、y的氢化物相互作用所生成的物质的电子式为 ,此物质在固态时属于 晶体。
查看答案和解析>>
科目: 来源:2010年郑州市盛同学校高二下学期期末考试化学试题 题型:填空题
一种离子晶体的晶胞如右图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子的配位数为_________,阴离子的配位数为________。
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是_______________m3。
(每空2分,共12分)
查看答案和解析>>
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
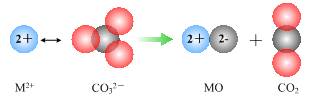
(12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/ kJ·mol-1 | 3791 | 3410 | 3223 | 3054 |
 NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。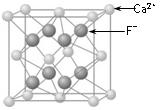
查看答案和解析>>
科目: 来源:09-10年如皋市高二下学期期末考试化学卷 题型:填空题
(12分)高温超导材料是科学家研究的重点物质之一。
⑴科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如下左图所示。该富勒烯化合物中的K原子和C60分子的个数比为 ▲ 。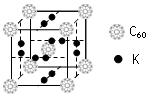
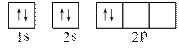
⑵某同学画出的C的核外电子排布(轨道表示式)如上右图所示,该电子排布图(轨道表示式)违背了 ▲ ,请你画出正确的电子排布图(轨道表示式) ▲ 。
⑶金属钾采用的是下列 ▲ (填字母代号)堆积方式。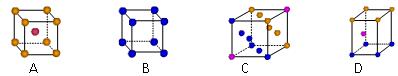
⑷富勒烯(C60)的结构如图。
①1 mol C60分子中σ键的数目为 ▲ 。
②已知:金刚石中的C-C的键长为154.45 pm,C60中C-C键长为145~140 pm。有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由: ▲ 。
查看答案和解析>>
科目: 来源:09—10年锦州市高二下学期期末考试化学卷 题型:填空题
(12分)某离子晶体晶胞结构如下图所示,X位于立方体的顶点,Y位于立方体中心。
试分析:
(1)晶体中每个Y同时吸引着__________个X,每个X同时吸引着__________个Y,该晶体的化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有_________________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为NA mol-1,计算此晶体中两个距离最近的X中心间的距离______________________cm。
查看答案和解析>>
科目: 来源:2010年黑龙江省鹤岗一中高二下学期期末考试化学试题 题型:填空题
(4分)选择下列物质填空(填写序号):
①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠
⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体
(1)固态时能导电的有
(2)熔化时不破坏化学键的有
(3)含有配位键的有
(4)含有非极性共价键的有
查看答案和解析>>
科目: 来源:2010年河北省唐山一中高二第二学期期末考试化学试卷 题型:填空题
(7分))如图是氯化钠的晶胞示意图,回答如下问题:
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
查看答案和解析>>
科目: 来源:09~10年黄冈中学高一下学期期末考试化学卷 题型:填空题
(10分)由阴阳离子通过离子键结合而成的晶体称为离子晶体,离子化合物固态时一般为晶体,在离子晶体中,阴、阳离子按一定规律在空间排列。下图是NaCl晶体的晶胞结构。(空心点为Cl—,实心球为Na+)
(1)在NaCl晶体中,每个Na+离子同时吸引着_______个Cl—离子,在周围与它最接近且等距离的Cl—共有___________个,Cl—离子位于Na+围成的___________体中心,而Na+离子数目与Cl-离子数目之比为___________。
(2)若CuO晶体中O2-采取NaCl晶胞结构中Na+的堆积方式,Cu2+占据O2-围成的正四面体空隙,则Cu2+占据O2-围成的正四面体空隙的占据率为 __________。
在离子晶体中,阴、阳离子具有或接近具有球形对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如下图),离子键的键长是相邻阴、阳离子的半径之和(如下图)。已知a为常数。试回答下列问题: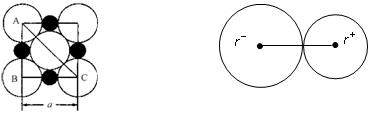
NaCl晶体中微粒间排布 NaCl晶体中离子键键长
(3)NaCl晶体离子键的键长为____________。
(4)Na+离子半径与Cl-离子半径之比 =_______________。
=_______________。
(已知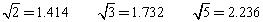 )
)
(5)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形成存在,现在29.25g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为____________。
查看答案和解析>>
科目: 来源:09~10年长沙同升湖实验学校高一下学期期末考试化学卷 题型:填空题
氮化硅(Si3N4)是一种新型的耐高温耐磨的材料,在工业上有广泛的用途,它的晶体类型是__________。
查看答案和解析>>
科目: 来源:09~10年长沙同升湖实验学校高一下学期期末考试化学卷 题型:填空题
有下列结论:①在晶体中只要有阴离子就一定有阳离子;②在晶体中只要有阳离子就一定有阴离子;③原子晶体的熔点一定比金属晶体高;④分子晶体的熔点一定比金属晶体的低。其中正确的是__________。?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com