
科目: 来源:2010-2011学年浙江省瑞安中学高一下学期期末联考化学试卷 题型:填空题
(8分)有下列八种物质:①氯化钙、②金刚石、③硫、④钛、⑤氢氧化钠、⑥钠、⑦二氧化硅、⑧干冰,回答有关这八种物质的问题。(用编号回答)
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
| 晶体类型 | | | | |
| 各组中物质的编号 | | | | |
查看答案和解析>>
科目: 来源:2011届江苏省常州市横山桥高级中学高三上学期期中考试化学 题型:填空题
(12分) 诺贝尔物理学奖曾授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B原子杂化轨道的类型为 ▲ ,同层分子间的主要作用为 ▲ 。
(2)K3[Fe(CN)6]晶体 中含有的化学键类型为 ▲ ,Fe3+与CN-之间能够形成化学键的原因是 ▲ 。
中含有的化学键类型为 ▲ ,Fe3+与CN-之间能够形成化学键的原因是 ▲ 。
(3)等物质的量的氧化物MO与SiC的电子总数相等,则M2+离子的核外电子排布式为 ▲ 。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,晶体中与每个M2+等距离且最近的几个O2-所围成的空间几何构型为 ▲ 。MO的熔点比CaO的高,原因是 ▲ 。
查看答案和解析>>
科目: 来源:2010-2011学年江苏省五校联考高二下学期期末考试化学试题 题型:填空题
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)下列4种物质熔点沸点由高到低排列为______________(填序号)
①金刚石(C—C) ②晶体硅(Si—Si) ③金刚砂(Si—C)
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个
顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(3)按所示格式填写下表有序号的表格:
| 原子序数 | 原子价层电子排布 | 周期 | 族 |
| 17 | ① | 第三 | ② |
| ③ | 3d54s1 | ④ | ⅥB |
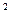 2s
2s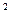 2p
2p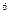 3s
3s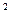 3p
3p 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。查看答案和解析>>
科目: 来源:2010-2011学年辽宁省沈阳二中高二6月月考化学试题 题型:填空题
Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族。
⑴Q的最高价氧化物,其固体属于 晶体,比较Q、X、Y 第一电离能由大到小的顺序 。
⑵ R的氢化物属于 分子(填“极性”或“非极性”)。
⑶X的常见氢化物的VSEPR模型是 ;
⑷已知Ti3+可 形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测
形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测 溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为 。
溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为 。
查看答案和解析>>
科目: 来源:2011届江西省上高二中高三热身考(理综)化学部分 题型:填空题
第三主族元素包括B、Al、Ga、In、Tl。
(1)在硼酸B(OH)3分子中,B原子与3个羟基相连,其晶体为层状结构。则分子中B原子杂化轨道的类型为 ,同层分子间的主要作用为 。
(2)氯化铝在气态中常以二聚分子Al2Cl6形式存在,在Al2Cl6分子中存在的化学键的类型有 、 。
(3)砷化镓属于第三代半导体,它能直接将电能转化为光能,其晶胞结构如右图所示。
①Ga的基态原子的核外电子排布式为 。
②在砷化镓的晶胞结构中,镓原子的配位数为____ 。
③在砷化镓的晶胞结构中,与同一砷原子相连的镓原子构成的空间构型为 。
查看答案和解析>>
科目: 来源:2011届湖北省襄阳五中高三第四次模拟考试(理综)化学部分 题型:填空题
(15分)随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,其具体操作步骤如下:①用分析天平称取研细干燥的NaCl固体 g于体积为V1毫升的定容容器A中;②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
g于体积为V1毫升的定容容器A中;②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题: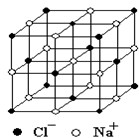
(1)定容容器A最好用________________(填实验仪器名称);
(2)滴定管是用酸式滴定管还是用碱式滴定管?_____________________,为什么?
______________________________________________________________;
(3)能否用水代替苯?_____________,为什么?
_______________________________________________________;
(4)测定离子化合物中离子间的间隔的方法是用X—射线衍射法,已知X—射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的核间距为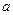 cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为:
cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为: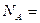 ______________________;
______________________;
(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为:______________。
查看答案和解析>>
科目: 来源:2011届陕西省师大附中、西工大附中高三第五次适应性训练(理综)化学部分 题型:填空题
(15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式 。
⑵钾、钙、镓的第一电离能从大到小的顺序是 。
⑶比较氟化钠和溴化钠的熔点:氟化钠 溴化钠(填“<”或“>”),分析其原因是 。
⑷举出两例说明锂与镁具有相似性:① 、② ,这种相似性称为 。
⑸用价层电子对互斥理论推断BF3空间构型为 ,NF3分子中N原子的杂化轨道类型为 ;在NH3·BF3中接受孤对电子的原子是 。
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
查看答案和解析>>
科目: 来源:2011届陕西省师大附中、西工大附中高三第五次适应性训练(理综)化学部分 题型:填空题
(14分)化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) 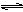 CH3CH2OH(g)+3H2O(g) △H=a kJ·mol-1
CH3CH2OH(g)+3H2O(g) △H=a kJ·mol-1
在一定压强下,测得上述反应的实验数据如下表。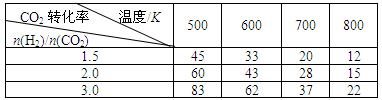
根据表中数据分析:
①上述反应的 0(填“大于”或“小于”)。
0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即 )比,平衡常数K值 (填“增大”、“减小”、或“不变”),对生成乙醇 (填“有利”或“不利”)。
)比,平衡常数K值 (填“增大”、“减小”、或“不变”),对生成乙醇 (填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示: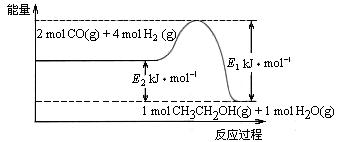
①写出CO和H2制备乙醇的热化学反应方程式 。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为 。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是 。
查看答案和解析>>
科目: 来源:2011届山西省高三第四次四校联考(理综)化学部分 题型:填空题
(15分)
(1)如图所示为冰晶石(化学式为 Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 (用化学式表示)。
Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 (用化学式表示)。
(2)H2S和H2O2的主要物理性质比较如下:
| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目: 来源:2010-2011学年山西省临汾一中高二下学期期中考试化学试卷 题型:填空题
(5分)在下列物质中:①K2SO4 ②H2O2 ③(NH4)2S ④Na2O2 ⑤C2H2 ⑥SiC
⑦Na2S ⑧单晶硅 ⑨Cu。(填序号)其中含有极性共价键的原子晶体是 ;其中既含有离子键又含有共价键的离子晶体是 ;其中含有极性共价键和非极性共价键的非极性分子是 ;直接由原子构成的晶体是 ;受热融化后化学键不发生变化的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com