
科目: 来源:2012届河北省衡水中学高三下学期二调考试理综试卷(带解析) 题型:填空题
(15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是: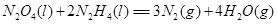
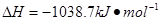
若该反应中有4mol N—H键断裂,则形成的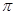 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式 , 1 mol O22+中含有的π键数目为 。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省瑞安中学高一3月月考化学试卷(带解析) 题型:填空题
(8分)现有①CaF2 ②金刚石 ③冰④干冰 ⑤Na2SO4 ⑥碘片 ⑦二氧化硅七种物质,按下列要求回答(填序号):
(1)晶体中既含离子键又含共价键的是_ ;(2)晶体熔化时需要破坏共价键的是____ _;(3)熔点最低的是___ __;(4)晶体中只存在一种微粒间作用力是____________;
查看答案和解析>>
科目: 来源:2012届河北省保定市高三上学期期末调研考试理科综合化学试卷(解析版) 题型:填空题
【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成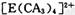 配离子,其中存在的化学键类型有 ______ (填序号);
配离子,其中存在的化学键类型有 ______ (填序号);
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若 具有对称的空间构型,且当
具有对称的空间构型,且当 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 的空间构型为 ____________ (填序号);
的空间构型为 ____________ (填序号);
a.平面正方形b.正四面体c.三角锥型 d. V型
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag ? cm-3,则该晶胞的体积是______cm-3(写出表达式即可)。
查看答案和解析>>
科目: 来源:2011-2012学年福建省罗源县第一中学高二下学期第一次月考化学试卷 题型:填空题
(11分)下图分别为NaCl、CsCl及金刚石的晶体结构模型。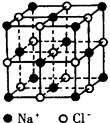

⑴ 在NaCl晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。在一个NaCl晶胞中,Cl-离子的个数等于________,Na+离子的个数等于________。
⑵ 在CsCl晶体中,每个Cs+离子周围与它最接近的且距离相等的Cs+离子共有_____个。每个Cs+离子周围与它最接近的且距离相等的Cl-离子共有_____个。
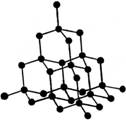
⑶ 在金刚石晶体中,每个C原子周围有________个C—C键,1 mol金刚石,含 C—C键________mol。
⑷ 如果将金刚石晶体结构模型中的C原子换成Si原子,并在每个Si—Si键中间插入O原子就成了SiO2的晶体结构模型。那么在SiO2晶体中,每个Si原子周围有______个O原子,每个O原子_______个Si原子;每个Si原子周围有_______个Si—O键,1mol SiO2中含有_____mol Si—O键。
查看答案和解析>>
科目: 来源:2012届江苏省南通市通州区高三重点热点专项检测化学试卷 题型:填空题
黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式 。K4[Fe(CN)6] 中Fe2+与CN-之间的作用力是 。
(2)CN-中碳原子的杂化方式为 ;1molCN-中含有π键的数目为 。
(3)金属钾、铁的晶体的晶胞结构如下图,钾、铁两种晶体晶胞中金属原子的配位数之比为 。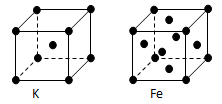
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为 。
查看答案和解析>>
科目: 来源:2011--2012学年四川省成都二十中高二上学期期中考试化学试卷 题型:填空题
(13分) 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B。
请回答:
(1)A元素的名称是________________;
(2)B元素的轨道表示式是________________,C的原子结构示意图是________________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是__________________________________________________________;
(3)E属于元素周期表中第________周期,第________族的元素,其元素名称是________;属于元素周期表中的 区(填元素分区),它的+2价离子的电子排布式为________________;
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________________;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是________________(只要求列出算式)。
查看答案和解析>>
科目: 来源:2011--2012学年四川省成都二十中高二上学期期中考试化学试卷 题型:填空题
(8分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)下图中配合物分子内的作用力有 (填编号)。
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
|

查看答案和解析>>
科目: 来源:2011--2012学年四川省成都二十中高二上学期期中考试化学试卷 题型:填空题
(12分)根据要求完成下列问题:
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、 B、 C、
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:_________、__________、_________。
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是 ,由非极性键形成的非极性分子是 ,能形成分子晶体的化合物是 ,含有氢键的晶体的化学式 ,属于原子晶体的是 ,四种物质熔点由高到低的顺序是 。
查看答案和解析>>
科目: 来源:2011-2012学年河南省淇县高级中学高二下学期第一次月考化学试卷 题型:填空题
(10分)某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点, 阴离子Y(○)位于立方体的中心,试分析:(1)晶体中Y的配位数是 ;X的配位数是 ;该晶体的化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个。
(3)该晶体的摩尔质量为Mg/mol,晶体密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间的距离为
cm。
查看答案和解析>>
科目: 来源:2012届江苏省无锡市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温为液态,易溶于CC14、苯等有机溶剂。固态Ni(CO)4
属于____晶体,基态Ni原子的电子排布式为 ;
| A.氢键 | B.离子键 | C.共价键 | D.配位键 |
 等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO
等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO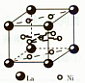
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com