
科目: 来源:2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(带解析) 题型:填空题
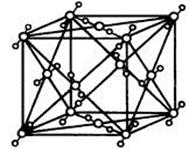
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式为 。
2)晶体中在每个X周围与它最接近且距离相等的X共有 个。
3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为 。
查看答案和解析>>
科目: 来源:2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(带解析) 题型:填空题
晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答。这个基本结构单元由 个硼原子组成,共含有 个B-B键。
查看答案和解析>>
科目: 来源:2012-2013学年福建省莆田一中高二下学期第一学段考试化学试卷(带解析) 题型:填空题
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:
(1)C、D两元素形成的化合物的晶体类型是 。BC2的结构式 ;在一定温度下,用x射线衍射法测BC2晶胞(晶体中最小的重复单位)边长: a=5.72×10-8cm,该温度下BC2的密度为
(2)若F是D的同主族下一周期元素,则F的电子排布式是: ,
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。(填分子式)
查看答案和解析>>
科目: 来源:2012-2013学年福建省莆田一中高二下学期第一学段考试化学试卷(带解析) 题型:填空题
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通过下列反应制取:CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
①X属于 晶体(填晶体类型)。
②MgO晶体的熔点比CaO高,主要原因是 。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
(3)硅烷(SiH4)的结构与甲烷相似。SiH4分子中共价键的类型是 ;硅烷能与硝酸银发生如下反应:SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3
该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
(4)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的
是 (填标号)。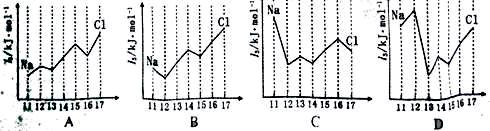
查看答案和解析>>
科目: 来源:2012-2013学年浙江省杭州二中高一下学期期中考试化学理科试卷(带解析) 题型:填空题
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2 ②各组分的物质的量浓度不再改变
③体系的压强不再发生变化 ④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2) 现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖。请用编号填写下列空白:
A.属于原子晶体的是_____________ ,其中熔点最高的是____________
B.属于分子晶体的是_____________________,其中分子构型为直线型的是____________ ,其电子式为_________________
C.含有非极性键的离子化合物是_______________,其中阳离子个数与阴离子个数之比为_________
查看答案和解析>>
科目: 来源:2013届辽宁省沈阳市第二十中学高三高考领航考试(三)化学试卷(带解析) 题型:填空题
【化学——选修物质结构与性质】(15分)第(6)题第一空为1分,其余为2分
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S + ZnO ="=" ZnS + H2O; C2H5SH + ZnO ="=" ZnS + C2H4 + H2O;
C2H5SH + H2 ="=" C2H6 + H2S; COS + H2 ="=" CO + H2S; CS2 + 4H2 ="=" CH4+ 2H2S
(1)钴原子在基态时核外电子排布式为________________________。
(2)下列有关分子结构的说法正确的是_______________(填字母)。
A.C2H4分子中有5个σ键和1个π键
B.COS分子(结构如右图)中键能C=O>C=S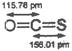
C.H2S分子呈V形结构 D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是____________________(填字母)。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:CS2>CO2
C.相同压强下沸点:C2H5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4)β-ZnS的晶胞结构如右图,晶胞中S2-数目为_________个。S2的配位数是_______________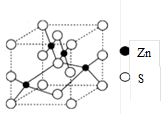
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于_____________________________________________________________。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]?8H2O,中心原子的配位数为_____________________。写出与CN—的电性相同,结构相似的一种微粒的电子式_________________
查看答案和解析>>
科目: 来源:2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(带解析) 题型:填空题
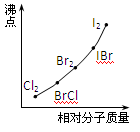
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: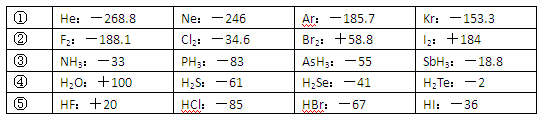
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
查看答案和解析>>
科目: 来源:2012-2013年四川昭觉中学高二上学期期中考试化学试卷(带解析) 题型:填空题
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一。2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如下图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。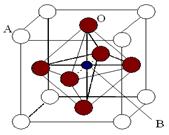
(1)用A、B、O(氧)表示此类特殊晶体的化学式 ;
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为 ;(用含x的代数式表示)
(3)Mn的外围电子排布式为 ,在元素周期表中的位置是第 周期,第 族;
(4)下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.CaO的熔点为2614℃,属于原子晶体
C.铬的堆积方式与钾相同,则其堆积方式如下图: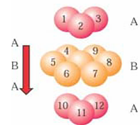
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com