
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
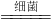 ______Cu2+______Fe2++______H++______S
______Cu2+______Fe2++______H++______S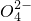
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
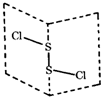 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl下列说法中错误的是
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl下列说法中错误的是查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
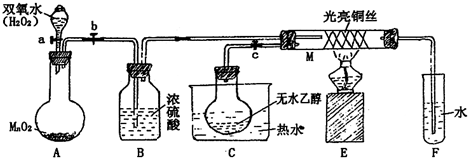
查看答案和解析>>
科目: 来源: 题型:解答题
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等.工业生产铝锭的工艺流程示意图如下: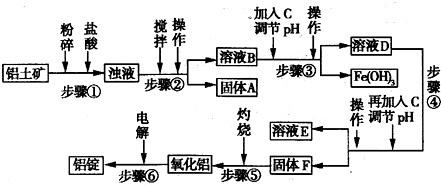
一些氢氧化物沉淀的pH如表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度为0.01mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子初始浓度为<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)实验室进行步骤④的操作名称为______.
(2)固体A的化学式为______,物质C的化学式为______.
(3)步骤④调节pH的范围为______.
(4)步骤⑥反应的化学方程式为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com