
科目: 来源:2011-2012学年四川省巴中市四县中高二上期期末联考化学试卷 题型:填空题
(10分)已知下列热化学方程式:
①CaCO3(s)=CaO+CO2(g);△H=177.7KJ
②C(s)+H2O(s)=" CO(g)+" H2(g);△H=-131.3KJ/mol
③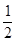 H2SO4(l)+NaOH(l)=
H2SO4(l)+NaOH(l)= 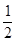 Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol
Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol
④C(s)+O2(g)= CO2(g) ;△H=-393.5KJ/mol
⑤CO(g)+ 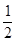 O2(g)= CO2(g);△H=-283KJ/mol
O2(g)= CO2(g);△H=-283KJ/mol
⑥HNO3(aq)+ NaOH(aq)= NaNO3(aq)+H2O(l) ;△H=-57.3KJ/mol
⑦2H2(g)+O2(g)=2H2O(l):△H=-517.6KJ/mol
(1)上述热学方程式中,不正确的有 ,(填编号),不正确的理由分别是 。
(2)根据上述信息,写出C转化为CO的热化学方程式 。
(3)上述反应中,表示燃烧热的热化学方程式有 (填编号)表示中和热的热化学方程式有 。(填编号)
查看答案和解析>>
科目: 来源:2011-2012学年吉林省吉林一中高二上学期质量检测化学试卷 题型:填空题
(2分)已知强酸与强碱反应的中和热为—57.3KJ/mol,请写出硫酸溶液与氢氧化钠溶液反应的中和热的热化学方程式 。
查看答案和解析>>
科目: 来源:2011-2012学年度陕西省宝鸡中学上学期高二期末考试化学试卷 题型:填空题
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷 题型:填空题
(每空格2分,计6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ·mol-1。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
查看答案和解析>>
科目: 来源:2012届山东省莱芜市高三上学期期末检测化学试卷 题型:填空题
(10分)工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式:

则反应 的
的 。
。
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使 难放电、阳极电极不溶解)。写出电解总方程式 。
难放电、阳极电极不溶解)。写出电解总方程式 。
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的 极发生 反应。(填“氧化”或“还原”)
(4)实验室用镀锌钢板与稀硫酸制取标准状况下的氢气4.48L,则该反应转移的电子数为
,消耗硫酸的物质的量是 。
查看答案和解析>>
科目: 来源:2011-2012学年福建师大附中高二上学期期末考试化学试卷 题型:填空题
(4分)2SO2(g)+ O2(g) 2SO3(g) △H =" a" kJ?mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g) △H =" a" kJ?mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答: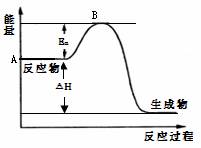
⑴图中A点表示_______________________,a=__________。
⑵Ea的大小对该反应的△H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目: 来源:2011-2012学年甘肃兰州一中高二上学期期末考试化学试卷 题型:填空题
(8分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)=H2O(g) △H=+44kJ·mol-1,则16 g液态肼和足量H2O2反应,生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)="2" NO2(g) △H="+67.7" kJ·mol-1, N2H4(g)+O2(g)= N2(g)+2H2O (g) △H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______________________ ____。
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷 题型:填空题
(4分)(1) 家用液化气的主要成分之一是丁烷,当58g丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2900kJ,试写出表示丁烷燃烧热的热化学方程式:
(2)稀盐酸和NaOH稀溶液反应生成1mol水放热57.3KJ, 该反应的热化学方程式为
查看答案和解析>>
科目: 来源:2012届山东省济南一中高三上学期期末检测化学试卷 题型:填空题
(8分).处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g)。发生反应为:
(1)已知:CO(g)+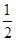 O2(g)=CO2(g) △H=-283.0kJ·mol—1
O2(g)=CO2(g) △H=-283.0kJ·mol—1
S(g)+O2(g)=SO2(g) △H=" -" 296.0 kJ·mol—1
试写出利用上述方法处理烟道气的热化学方程式
(2)在容积为2L的密闭容器中,充入4molCO和2molSO2,在一定条件下发生反应2CO(g)+SO2(g) S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则:
S(g)+2CO2(g),CO2的物质的量分数随时间的变化如图所示,则: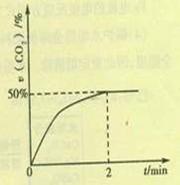
①0-2min内的平均反应速率v(CO)= 。
②该温度下,上述反应的平衡常数K= (填数值)。
③2min后改变下列条件能使上述反应的反应速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度 c.及时分离出二氧化碳 d.增加SO2的浓度
查看答案和解析>>
科目: 来源:2012届新疆乌鲁木齐一中高三第三次月考化学试卷 题型:填空题
(8分)(I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题: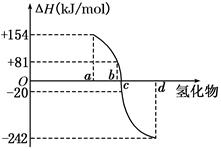
请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;
写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H =______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热△H ="=" KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极: 正极:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com