
科目: 来源:2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷(带解析) 题型:填空题
(18分)(2011·黄岗中学高二质检)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是__________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________;
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”);
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷(带解析) 题型:填空题
(10分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
(2)右图是198 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:______________________________________________________________________________________________________。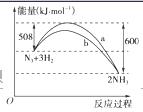
查看答案和解析>>
科目: 来源:2013届甘肃省甘谷一中高三上学期第一次检测考试理综化学试卷(带解析) 题型:填空题
(14分)水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的炭制得:C (s) + H2O(g) CO (g) +H2 (g) △H=+131kJ?mol-1
CO (g) +H2 (g) △H=+131kJ?mol-1
⑴T温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
 CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)查看答案和解析>>
科目: 来源:2011-2012年呼伦贝尔市牙克石林业一中高一下学期期末考试化学试卷(带解析) 题型:填空题
(6分).2CO(g)+O2(g) 2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
(1)图中A点表示:____________________________________;E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH = ________kJ/mol。
查看答案和解析>>
科目: 来源:2011-2012学年广东省实验中学高一下学期期末考试化学试卷(带解析) 题型:填空题
(12分) Ⅰ.下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。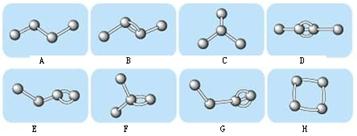
(1)图中属于烷烃的是 (填编号)属于烯烃的是 ,(填编号)
(2)上图中与B互为同分异构体但不属于同种类的物质的是: 。(填编号)
Ⅱ.课本“交流?研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收249kJ的能量;形成水分子中1 mol H—O键能够释放463kJ能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。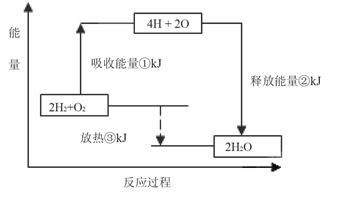
① kJ ② kJ ③ kJ
查看答案和解析>>
科目: 来源:2011-2012学年安徽省六安三中高二上学期期末考试化学A卷(带解析) 题型:填空题
(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g) △H=-24.8kJ/mol
Fe203(s)+1/3CO(g)="=" 2/3Fe3O4(s)+ 1/3C02(g) △H=-15.73kJ/mol
Fe304(s)+CO(g)==3FeO(s)+C02(g) △H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______________________
查看答案和解析>>
科目: 来源:2011-2012学年河北省涿州铁中高二上学期期中考试化学试卷(带解析) 题型:填空题
(6分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ__________
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
查看答案和解析>>
科目: 来源:2011-2012学年河北省辛集三中高二化学选修四期中试卷(带解析) 题型:填空题
家用液化气的主要成分之一是丁烷,试写出表示丁烷燃烧热的热化学方程式:
(查阅资料:丁烷的燃烧热为---2900kJ/mol。)
(1)
(2)已知:C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol;
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为
查看答案和解析>>
科目: 来源:2011-2012学年河北省迁安市高二第一学期期中考试化学试卷(带解析) 题型:填空题
(12分)⑴已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为_______________________________________________。
⑵将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
____________________________________。
⑶右图为工业上氯碱工业的电解槽示意图,据图回答:
①图中a、b、c处物质名称分别是: a_________________;b________________;c___________________。
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为__________________________。
⑷反应2A B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。
①若温度升高,平衡向正反应方向移动,则正反应是__________热反应;
②若B为固体,降低压强平衡向逆反应方向移动,则A呈____________态;
③若A是气态时,加压时,平衡不移动,则B为_________态,C为________态。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州四中高二下学期期中考试化学试卷(带解析) 题型:填空题
(9分)
(1)家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:
(2)已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)体和CO2(g)的热化学反应方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com