
科目: 来源: 题型:单选题
 Cu2++SO2↑+2H2O
Cu2++SO2↑+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
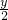 ,R3+是还原剂
,R3+是还原剂查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
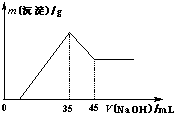 准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为
准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为查看答案和解析>>
科目: 来源: 题型:解答题
 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾. 3Zn(OH)3+2Fe(OH)3+4KOH该电池放电时的负极反应式为______,若外电路有5.418×1022个电子通过,则正极有______g高铁酸钾参与反应.
3Zn(OH)3+2Fe(OH)3+4KOH该电池放电时的负极反应式为______,若外电路有5.418×1022个电子通过,则正极有______g高铁酸钾参与反应.查看答案和解析>>
科目: 来源: 题型:解答题
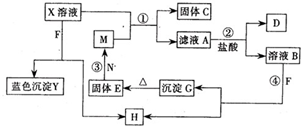 已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如图,(部分反应产物已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com