
科目: 来源:2010年重庆理科测试模拟试卷(一)化学部分 题型:单选题
对于平衡体系2SO2(g) + O2(g) 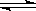 2SO3(g);ΔH<0.下列结论中正确的是
2SO3(g);ΔH<0.下列结论中正确的是
| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.48倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量之比为2:1 |
| C.若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
查看答案和解析>>
科目: 来源:2010年江苏省栟茶高中高三模拟考试化学试卷 题型:单选题
某温度下,在一密闭容器中发生如下可逆反应:2E(g)  F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
F(g)+xG(g);△H<0。若起始时E浓度为a mol·L-1,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1;若E的起始浓度改为 2a mol·L-1,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
| A.升高温度时,正反应速率加快、逆反应速率减慢 |
| B.若x=l,容器体积保持不变,新平衡下E的体积分数为50% |
| C.若x=2,容器体积保持不变,新平衡下F的平衡浓度大于0.5a mol·L-1 |
| D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol |
查看答案和解析>>
科目: 来源:2010届陕西留坝中学高三模拟考试化学卷 题型:单选题
高温及一定催化剂作用下,某反应达平衡,平衡常数K= 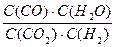 .恒容时,温度升高,H2浓度减小,下列说法正确的是( )
.恒容时,温度升高,H2浓度减小,下列说法正确的是( )
| A.将容器体积变为原来2倍,CO的平衡浓度变为原来的2倍 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO2 +H2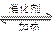 CO+H2O ;△H>O CO+H2O ;△H>O |
查看答案和解析>>
科目: 来源:2009—2010学年存瑞中学第二学期第二阶段考试高二化学试题 题型:单选题
在定温、定容条件下,不能标志H2(g)+ I2 (g)  2HI (g)达平衡的是
2HI (g)达平衡的是
| A.单位时间内消耗amol H2,同时消耗 2amol HI |
| B.容器内的总压强不随时间变化 |
| C.容器内H2、I2不再减少,HI不再增加 |
| D.单位时间内每生成amol HI,同时a NA个HI分子分解 |
查看答案和解析>>
科目: 来源:2010年高考化学试题分项专题八 化学反应速率和化学平衡 题型:单选题
反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时。M的体积分数
cP(g)+dQ(g)达到平衡时。M的体积分数 (M)与反应条件的关系如图所示。其中:表示反应开始时N的物质的量之比。下列说法正确的是
(M)与反应条件的关系如图所示。其中:表示反应开始时N的物质的量之比。下列说法正确的是
| A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加 |
| B.同压同Z时,升高温度,平衡时Q的体积分数增加 |
| C.同温同Z时,增加压强,平衡时Q的体积分数增加 |
| D.同温同压时,增加Z,平衡时Q的体积分数增加。 |
查看答案和解析>>
科目: 来源:2010年高考化学试题分项专题十 电解质溶液 题型:单选题
光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是
| A.该溶液中存在着SO2分子 |
| B.该溶液中H+浓度是SO2- 3浓度的2倍 |
| C.向该溶液中加入足量的酸都能放出SO2气体 |
| D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液 |
查看答案和解析>>
科目: 来源:2010年北京普通高等学校招生全国统一考试理科综合能力测试化学 题型:单选题
某温度下, 的平衡常数
的平衡常数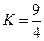 .该温度下在甲、乙、丙三个恒容密闭容器中,
.该温度下在甲、乙、丙三个恒容密闭容器中,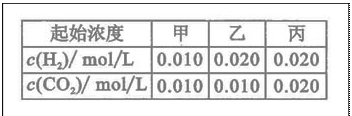
投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
查看答案和解析>>
科目: 来源:2010年高考化学试题分项专题八 化学反应速率和化学平衡 题型:单选题
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)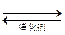 2N2(g)+3H2O
2N2(g)+3H2O 
在恒容的密闭容器中,下列有关说法正确的是
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
查看答案和解析>>
科目: 来源:2010年高考化学试题分项专题十 电解质溶液 题型:单选题
下列各表述与示意图一致的是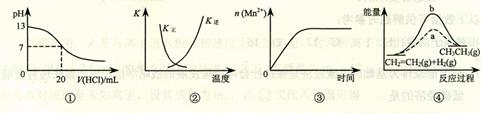
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目: 来源:2009-2010学年度唐山二中高二第二学期期中化学试卷 题型:单选题
下列各反应达到化学平衡后,增大压强或降低温度,都能使化学平衡向正反应方向移动的是( )
A.C(s) + CO2(g) 2CO(g) (正反应为吸热反应) 2CO(g) (正反应为吸热反应) |
B.3O2(g) 2O3(g)(正反应为吸热反应) 2O3(g)(正反应为吸热反应) |
C.CO(g) + NO2(g) CO2(g)+NO(g) (正反应为放热反应) CO2(g)+NO(g) (正反应为放热反应) |
D.N2 (g) + 3H2(g) 2NH3(g) (正反应为放热反应) 2NH3(g) (正反应为放热反应) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com