
科目: 来源:2011届山东省潍坊市三县最后一次模拟联考(理综)化学部分 题型:填空题
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
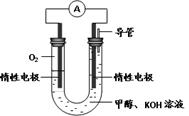
查看答案和解析>>
科目: 来源:2011届辽宁省沈阳二中高三第五次模拟考试(理综)化学部分 题型:填空题
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g) + 3H2(g)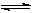 CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1
CH3OH(g) + H2O(g) △H=" -49.0" kJ·mol-1
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标):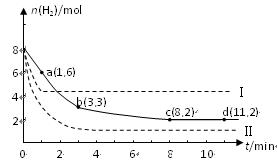
回答下列问题:
(1)该反应在 条件下能自发进行(填编号)。
A、高温 B、低温 C、任何温度
(2)该反应在0~8 min内CO2的平均反应速率是 mol/(L?min)。
(3)该反应的平衡常数K= 。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条
件下平衡常数为K2,则K、K1和K2的大小关系是 。
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目: 来源:2010-2011学年山西省临汾一中高一下学期期中考试化学试卷 题型:填空题
(10分)工业合成氨的反应: 是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
⑴相同条件下,1 mol N2和3 mol H2所具有的能量 (“大于”、“小于”、“等于”)2 molNH3具有的能量;
⑵如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量 (“大于”、“小于”、“等于”)上述数值,其原因是 ;
⑶实验室模拟工业合成氨时,在容器为2L的密闭容器内,反应经过10min后,生成10 mol NH3,则用N2表示的该反应速率为: ;
⑷一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值 d.N2和H2的浓度相等
e. N2、H2和NH3的体积分数相等 f.反应达到最大限度
查看答案和解析>>
科目: 来源:2011届河南省信阳市高三第二次调研考试化学试卷 题型:填空题
(18分)(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,
写出该反应的化学方程式并配平_________________________________。若反应过程中
转移了0.3mol电子,则氧化产物的质量是____________g。
(2)同一物质呈气态的熵值最大,液态的熵值次之,固态的熵值最小。若同温同 压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
b.等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图l所示:
请回答下列问题:
H2与硫化合的反应______________热量(填“放出”或“吸收”)。根据题目所给信息,请解释为什么Te和H2不能直接化合_______________________________ _____
_____ _____.
_____.
(3)在复杂的反应中,要考虑反应的先后顺序。已知 +
+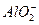 +2H2O
+2H2O Al(OH)3↓ +NH3·H2O,向含有等物质的量的
Al(OH)3↓ +NH3·H2O,向含有等物质的量的 、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
第二个离子反应的离子方程式是__________________________________.
最后—个离子反应的离子方程式是________________________________.
(4)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示: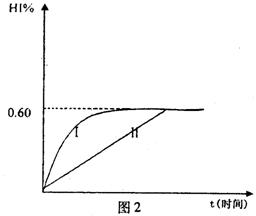
①达到平衡时,I2(g)的物质的量浓度为________mol/L.
②保持加入的反应物的物质的量不变,若改变反应条件,在某一条件下HI%的变化如曲线l所示,则该条件可能是(写出所有的可能性)___________________________________________________________在这种条件下,平衡常数K值____________(填“增大”、“变小”、。不变”或“可能变大也可能变小”)
③若保持温度不变,在另一相同的2L密闭容器中加入1molH2(g)和2molHI(g),发生反应达到平衡时,H2的体积分数为________。
查看答案和解析>>
科目: 来源:2011届陕西省西安市高三第三次质检(理综)化学部分 题型:填空题
在元素周期表中处于相邻位置的元素在结构和性质上有许多相似的地方。第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H O外,还有H
O外,还有H O
O ;碳元素的氢化物除CH
;碳元素的氢化物除CH 外,还有C
外,还有C H
H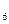 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N H
H 等。
等。
(1)碳原子之间可以结合成链状结构,氮原子之间也可以形成链状结构,假设氮原子间只以氮氮单键形式连接成链状,并形成氢化物,则该系列氢化物的通式为 。
(2)该系列中的N H
H 是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N
是“神六”发射时火箭所用的液体燃料,液态的四氧化二氮作氧化剂,此液态燃料的优点是产生的能量大且无污染。已知40g N H
H 在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。
在火箭发射时反应中放出710kJ热量,写出火箭发射时该反应的热化学方程式: 。
(3)该系列物中的NH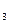 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为: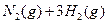


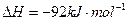
I.在一定温度下,将1.5molN 和6 molH
和6 molH 通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
通入到一个固定容积为VL的密闭容器中,当反应达到平衡时,容器内气体的压强为起始时的80%,则
此时反应放出的热量为 kJ.
H 的转化率= 。
的转化率= 。
该温度下合成氨反应的平衡常数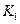 = (只列数字表达式)
= (只列数字表达式)
II.在保持温度不变,相同体积的密闭容器中,将起始的物质的量改为amolN 、bmolH
、bmolH 、cmolNH
、cmolNH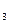 ,平衡时NH
,平衡时NH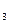 的物质的量分数为25%,则:
的物质的量分数为25%,则:
达到平衡时,I和II放出的热量 (填字母代号)
| A.一定相等 |
| B.前者一定小于后者 |
| C.前者等于或小于后者 |
| D.前者等于或大于后者 |
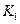 和
和 ,同
,同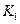
 (填“﹥”、“﹤
(填“﹥”、“﹤ ”或
”或 “=”)
“=”)查看答案和解析>>
科目: 来源:2010-2011学年江西省鄱阳县油墩街中学高一下学期期中考试化学试卷 题型:填空题
(4分)化学反应的限度是当_ __和 __相等,反应物和生成物的 __保持不变时,所达到的一种看似 的“平衡状态”。
查看答案和解析>>
科目: 来源:2011届广东省高三全真高考模拟(四)(理综)化学部分 题型:填空题
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI  H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目: 来源:2011届广东省高三全真高考模拟试卷(二)(理综)化学部分 题型:填空题
某化学反应2A B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。
B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。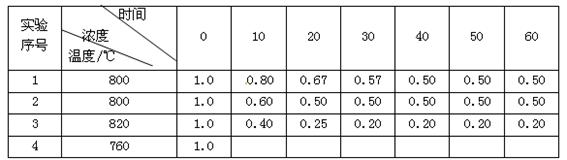
根据上述数据,回答下列问题:
(1)在实验1中,0~10min内的反应速率v(A)为 mol?L-1??min-1。
(2)与实验1相比,实验2的反应速率更 (填“快”或“慢”),其原因可能是 。
(3)根据实验1和实验3的数据分析升温对该反应的影响,写出两条结论:① ;
② 。
(4)实验4只改变温度,其它条件不变。请在答题卡的相应位置画出实验1和实验4的“浓度—时间”关系曲线。 www.k@s@5
www.k@s@5 @u.com
@u.com
查看答案和解析>>
科目: 来源:2011届广东汕头市普通高中毕业班教学质量监测理综化学部分 题型:填空题
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO2 |
| C.使用高效催化剂 | D.升高温度 |

查看答案和解析>>
科目: 来源:2011届上海市吴淞中学高三上学期第一次月考化学试卷 题型:填空题
将一定量的SO2和含0.7mol的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2 (g) + O2(g)  2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
(1)判断该反应达到平衡状态的标志是______________。
A.SO2和SO3浓度相等
B.SO2的百分含量保持不变
C.SO3的生成速率与SO2的消耗速率相等
D.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是_____________。
A. 向装置内再充入N2 B. 向装置内再充入O2
C. 改变反应的催化剂 D. 升高温度
(3)求该反应达到平衡时SO2的转化率
(4)若将平衡混合气体的5 %通入过量的BaCl2溶液,生成沉淀多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com