
科目: 来源:2012-2013学年云南省大理州宾川县第四高级中学高二4月月考化学卷(带解析) 题型:填空题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________
________________________________________________________________________。
(2)要加快上述实验中气体产生的速率,还可采取的措施有______________________
__________________________________________________________________(答两种)。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源:2012-2013学年云南省大理州宾川县第四高级中学高二4月月考化学卷(带解析) 题型:填空题
在密闭容器里,通入x mol H2和y mol I2 (g),改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1) 升高温度 ;
(2) 加入催化剂 ;
(3) 充入更多的H2 ;
(4) 扩大容器的体积 ;
(5) 容器容积不变,通入氖气 。
查看答案和解析>>
科目: 来源:2012-2013学年云南省大理州宾川县第四高级中学高二4月月考化学卷(带解析) 题型:填空题
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示图中t1~t2速率变化的主要原因是 __________,t2~t3速率变化的主要原因是 。
查看答案和解析>>
科目: 来源:2012-2013学年广东省揭阳第三中学高一下第二次阶段考试理科化学卷(带解析) 题型:填空题
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 ,一定时间后反应速率逐渐减慢,其原因是
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 |
| B.氯化钠固体 |
| C.氯化钠溶液 |
| D.浓盐酸 |
查看答案和解析>>
科目: 来源:2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(带解析) 题型:填空题
在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:
Cr2O72—+H2O 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈 色,
因为 。
查看答案和解析>>
科目: 来源:2012-2013学年山东省临沭一中高二10月学情调查化学试卷(带解析) 题型:填空题
I.在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断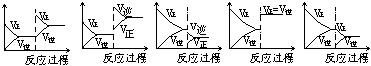
| A. | B. | C. | D. E. |
 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O查看答案和解析>>
科目: 来源:2012-2013学年福建省厦门大学附属科技中学高二下学期期中考化学卷(带解析) 题型:填空题
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |

查看答案和解析>>
科目: 来源:2012-2013学年北京市第六十六中学高一下学期期中考试化学试卷(带解析) 题型:填空题
影响化学反应速率的因素很多。在下列事实中,影响反应速率的外界条件分别为:
(1)夏天的食品易霉变,冬天不易发生该现象 ;
(2)在5﹪的H2O2溶液中加入1滴~2滴1mol∕LFeCl3溶液,很快产生气体 ;
(3)工业上常将固体燃料粉碎,以提高燃烧效率 ;
(4)硫在氧气中比在空气中燃烧更快 ;
(5)工业合成氨通常要在高压下进行 。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省南京三中高二下学期期中考试化学试卷(带解析) 题型:填空题
反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:(填增大,减小或不变)
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:(填增大,减小或不变)
(1) 升温___ ; (2) 增大压强____ ; (3) 增大容器容积 ____ ;
(4) 加正催化剂____ ; (5) 加入B____ 。
查看答案和解析>>
科目: 来源:2012-2013学年四川省成都外国语学校高一下学期期中考试化学试卷(带解析) 题型:填空题
(I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | | | | |
| ③ | | 粗颗粒 | | |
| ④ | | | |
 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
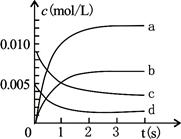
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com